As propriedades periódicas dos elementos químicos são aquelas que se repetem ao longo da Tabela Periódica. Tais propriedades estão relacionadas com a estrutura dos átomos dos elementos: ao passo que o número atômico cresce, seus valores aumentam ou diminuem a cada período.
Raio atômico
A eletrosfera de um átomo não é bem delimitada, por isso, é praticamente impossível determinar o tamanho atômico. Assim, existem duas características que devem ser consideradas para representar a proporção de cada átomo:
- Número de camadas eletrônicas: quanto maior o número de camadas eletrônicas, maior o tamanho do átomo.
- Número de prótons: quanto maior o número de prótons, maior a força de atração do núcleo sobre a eletrosfera, e, portanto, menor o tamanho do átomo.
Através desses dois fatores é possível chegar ao raio atômico, que é a metade da distância entre os núcleos de dois átomos do mesmo elemento. Trata-se de uma propriedade periódica porque seus valores crescem ou decrescem conforme aumenta o número atômico. Resumidamente temos:
- Na mesma família ou grupo de elementos, o raio atômico cresce de cima para baixo, devido ao aumento do número de camadas eletrônicas;
- No mesmo período da tabela, o raio atômico cresce da direita para a esquerda, devido à diminuição do número de prótons que ocorre nessa direção.
.jpg)
Eletroafinidade
A eletroafinidade ou afinidade eletrônica é a energia liberada quando o átomo neutro no estado gasoso recebe um elétron. Essa grandeza mede a intensidade com que o átomo “prende” esse elétron recebido. Tal propriedade periódica é inversa ao raio atômico, ou seja, quanto menor o raio, maior a eletroafinidade dos elementos de uma mesma família ou de um mesmo período.
.jpg)
Ponto de fusão (PF) e ponto de ebulição (PE)
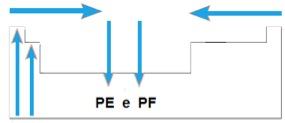
Os pontos de fusão e os pontos de ebulição são as temperaturas nas quais os elementos químicos entram em fusão ou ebulição, respectivamente. Tais propriedades não seguem uma sequência linear como as anteriores:
- Na maioria das famílias, os elementos de maior PE e PF estão situados na parte inferior da tabela. Já nas famílias 1A e 2A, os elementos localizados na parte superior são os que apresentam maiores PE e PF.
- Em geral, no mesmo período, PE e PF dos elementos aumentam das extremidades para o centro da tabela.
Esquematicamente, temos:
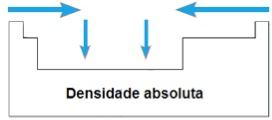
Densidade absoluta
A densidade absoluta ou massa específica de um elemento é a razão da sua massa pelo seu volume. Num mesmo período da tabela periódica, os valores dessa propriedade crescem das extremidades para o centro, em geral. Nas famílias 1A e 4A, a densidade absoluta cresce conforme aumentam as massas atômicas, isto é, de cima para baixo.
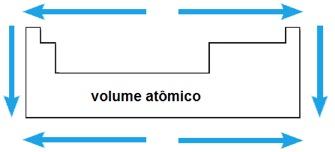
Volume atômico
O volume atômico de um elemento químico corresponde ao volume ocupado por 1 mol (6,02 x 1023 átomos) no estado sólido. Num mesmo período, o volume atômico aumenta do centro para as extremidades da tabela periódica; enquanto numa mesma família, o valor do volume atômico cresce de acordo com o aumento do raio atômico.
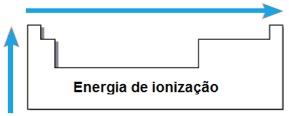
Energia de ionização
A energia ou potencial de ionização é a energia necessária para que um ou mais elétrons sejam retirados de um átomo isolado no estado gasoso. Tal propriedade periódica é proporcional ao raio atômico do átomo: quanto maior o raio atômico, menor é a atração do núcleo sobre o elétron mais afastado, logo, a energia necessária para retirar esse elétron é menor.
Num mesmo período, a energia de ionização aumenta da direita para a esquerda, e numa mesma família, de baixo de para cima.
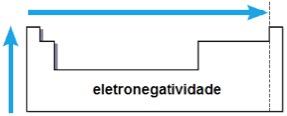
Eletronegatividade
Eletronegatividade é a atração exercida pelo núcleo sobre os elétrons numa ligação química. Essa propriedade também está associada ao raio atômico: quanto menor o raio atômico, maior é a força de atração, uma vez que a distância entre o núcleo e a eletrosfera é menor.
Numa mesma família, a eletronegatividade cresce de baixo para cima, e num mesmo período, da esquerda para a direita da tabela periódica. Tal propriedade não se aplica apenas aos gases nobres.
Referências bibliográficas
FELTRE, Ricardo. Química volume 1. São Paulo: Moderna, 2005.
USBERCO, João, SALVADOR, Edgard. Química volume único. São Paulo: Saraiva, 2002.
Por: Mayara Lopes Cardoso