De modo geral, as reações químicas envolvem perda ou ganho de energia, especialmente sob a forma de calor. Toda reação que ocorre com absorção de calor é chamada de reação endotérmica, enquanto aquelas que ocorrem com liberação de calor são chamadas de exotérmicas.
Para entender melhor qual é a origem do calor absorvido ou liberado nas reações químicas, primeiro é preciso esclarecer os conceitos de energia. Basicamente, a energia pode ser classificada em dois tipos: energia cinética e energia potencial.
A energia cinética é aquela que está relacionada ao movimento, como é o caso das águas de cachoeiras, a energia do sol e a energia dos ventos. Já a energia potencial está associada à posição, ou seja, ela permanece acumulada num sistema e, mais tarde, pode ser utilizada para produzir trabalho. As águas de uma barragem, por exemplo, apresenta uma determinada quantidade de energia potencial, que pode ser convertida em trabalho mecânico quando caem nos dutos e movimentam os geradores de uma hidrelétrica.
Todas as substâncias contêm uma dada quantidade de energia potencial acumulada em seu interior, que é resultante das ligações químicas entre seus átomos, das forças que atraem e repelem os núcleos e os elétrons das moléculas, e dos movimentos de vibração, rotação e translação de suas partículas. Sabemos também que, numa reação, para que uma ligação química seja rompida, é preciso fornecer energia, enquanto, para formá-la, há liberação de energia.
Sendo assim, quando a energia interna total (entalpia) dos reagentes for maior do que a energia interna dos produtos da reação, ocorrerá uma sobra de energia, que será liberada em forma de calor, caracterizando uma reação exotérmica. Em reações desse tipo, a energia liberada na formação das ligações químicas dos produtos é maior do que a energia consumida na quebra as ligações entre os reagentes. Veja alguns exemplos de reações exotérmicas:
• Reação entre o ácido clorídrico (HCl) e hidróxido de sódio (NaOH).
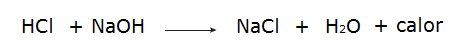
• Todos os processos de combustão são processos exotérmicos, como a queima da gasolina, por exemplo.
• A queima da glicose durante o processo de respiração que ocorre em nossas células.
• A reação dos gases hidrogênio (H2) e nitrogênio (N2), que produz a amônia (NH3).
Em contrapartida, quando a energia total dos reagentes for menor que a energia total dos produtos da reação, será necessário absorver energia para que a reação ocorra, o que caracteriza uma reação endotérmica. Nessas reações, a energia necessária para romper as ligações químicas dos reagentes é maior que aquela desprendida na formação dos produtos, por isso há absorção de energia sob a forma de calor. Veja alguns exemplos:
• A decomposição da amônia.
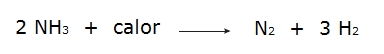
• A oxidação do gás nitrogênio.
• A produção do ferro metálico a partir da hematita (Fe2O3).
• O cozimento dos alimentos.
Podemos representar as reações graficamente:

Nas mudanças de estado físico da matéria também há perda ou ganho de calor. No estado sólido, as moléculas encontram-se mais coesas e em posições fixas; na fase líquida, as moléculas já se movimentam com certa liberdade; ao passo que, na fase gasosa, as moléculas se movimentam em todas as direções, com alta velocidade e maior liberdade que os outros estados. Dessa forma, para que uma substância passe de um estado para o outro e suas moléculas sejam reordenadas, há sempre a necessidade de absorver ou liberar calor.
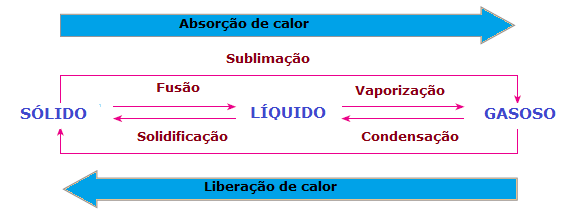
Assim sendo, podemos concluir que a fusão, a vaporização e a sublimação são processos endotérmicos, enquanto a solidificação e a condensação são processos exotérmicos. Nesses casos não há reação química, mas sim, transformações ou fenômenos físicos com absorção ou liberação de calor.
Referências
FELTRE, Ricardo. Química volume 2. São Paulo: Moderna, 2005.
MACHADO, Andrea Horta, MORTIMER, Eduardo Fleury. Química volume único. São Paulo: Scipione, 2005.
USBERCO, João, SALVADOR, Edgard. Química volume único. São Paulo: Saraiva, 2002.
Por: Mayara Lopes Cardoso
Veja também:
- Reações Espontâneas e Não Espontâneas
- Energia Cinética, Potencial e Mecânica
- Termoquímica
- Cinética Química