Titulação é o método pelo qual se determina uma quantidade desconhecida de uma substância particular, mediante a adição de um reativo-padrão que reage com ela em proporção definida e conhecida.
A adição de um reativo-padrão (um reativo de concentração conhecida e frequentemente designado como reativo-titulado) se regula e se mede de alguma maneira, requerendo-se um método de indicação para saber quando a quantidade do reativo normal juntado é precisamente a suficiente para reagir quantitativamente com a substância que se determina.
Por conseguinte, conhecendo a proporção em que reagem as substâncias e tendo determinado a quantidade de uma substância (o reativo titulado) necessária para reagir nesta proporção, pode-se calcular facilmente a quantidade desconhecida de substância presente no frasco da reação.
Em uma titulação, o ponto em que a quantidade de reativo titulado adicionado é exatamente a suficiente para que se combine em uma proporção estequiométrica, ou empiricamente reproduzível com a substância que se determina, chama-se ‘ponto de equivalência’. O ponto final de uma titulação deve coincidir com o ponto de equivalência ou estar muito próximo dele. A diferença entre os pontos de equivalência e final se chama intervalo do indicador.
As titulações se realizam quase sempre com soluções ou dissoluções, porém também é fácil realizá-las com substâncias nos estados gasoso, sólido e de fusão, se se dispõe de um equipamento adequado.
Exemplo de titulação
Vejamos como é feita a titulação da solução de Ácido Sulfúrico de concentração X mol/L por meio de uma solução de hidróxido de sódio de concentraçao 0,10 mol/L.
1. Por meio de uma pipeta ou de uma bureta medimos o volume de 25,00mL da soluçao de Ácido Sulfúrico e transferimos essa solução para um erlenmeyer, adicionando algumas gotas de solução alcoólicas de fenolftaleína, que ira atuar como indicador. A solução no erlenmeyer ficará incolor, pois a fenolftaleína em meio ácido permanece incolor.
2. Colocamos a solução de hidróxido de sódio de concentração 0.10 mol/L no interior de uma bureta e fazemos o nível dessa solução coincidir com o zero da bureta. Agora, iniciamos a titulação propriamente dita. Gotejamos a solução de hidróxido de sódio no interior do erlenmeyer, sob agitação continua. À medida que a solução de hidróxido de sódio vai sendo introduzida no frasco, a quantidade de ac. Sulfúrico no seu interior vai diminuindo, porque há neutralização do ácido pela base.
3. Enquanto houver Ácido Sulfúrico no erlenmeyer, a solução no seu interior permanecerá incolor. Num dado instante, ao cair uma gota de hidróxido de sódio no erlenmeyer, a solução ficará avermelhada. Nesse instante fecha-se a torneira da bureta e está terminada a titulação.
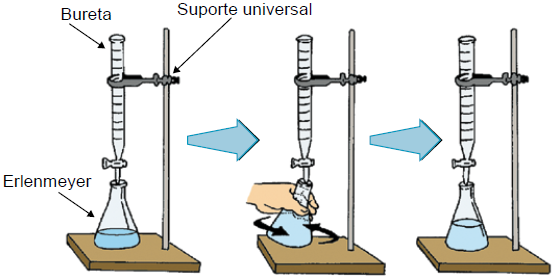
A última gota de NaOH que caiu contêm excesso de NaOH, pois apareceu a coloração avermelhada, porém esse excesso é desprezível. Qiando a solução passa de incolor a avermelhada, significa que o Ácido sulfúrico reagiu completamente com o NaOH (fim da titulação)
Volume de NaOH gasto na titulação: 22,50 mL. Portanto, 25,00 mL de solução de Ácido Sulfúrico de concentração X mol/L exigiram na titulação 22,50 mL de NaOH de concentração 0.10 mol/L.
Tipos de Titulação
Ácido-base (acidimetria-alcalimetria):
Se uma solução de ácido é titulada com uma solução alcalina (ou seja na acidimetria) as hidroxilas da solução alcalina combinam-se com os hidrogênios ionizáveis do ácido, aumentando o pH da solução; em determinado pH o ponto de equivalência é atingido e a reação terminada. O mesmo raciocínio se aplica as soluções alcalinas tituladas por ácidos (isto é, a alcalimetria): o pH no ponto de equivalência depende da natureza e da concentração dos reagentes.
Oxidação-redução (redox):
Baseiam-se nos processos em que há transferência de elétrons (isto é, nas reações de oxirredução. Os agentes oxidantes ou redutores apresentam diferentes atividades químicas. Oxidantes fortes têm pronunciada tendência para ganhar elétrons, que são capazes de remover de grande número de redutores. O mesmo acontece na perda de elétrons em relação aos redutores. Sendo a intensidade da ação oxidante ou redutora de um sistema determinada pelo seu potencial de de oxidação.
Precipitação:
Uma reação com formação de precipitado pode ser utilizada para titulação, desde que processe com velocidade adequada, que seja quantitativa e que haja um modo de determinar o momento em que o ponto de equivalência foi alcançado.
Na prática essas condições limitam seriamente o número de reações de precipitação utilizáveis. Muitas reações de precipitação precisam de tempo relativamente longo para serem consideradas quantitativas.
Formação de complexos:
As titulações complexométricas baseiam-se na formação de um complexo solúvel. São reações extremamente comuns, mas poucas satisfazem as condições para serem usadas em química analítica: na sua maioria, os complexos não são estáveis bastante para permitir uma titulação.
Os complexos que podem ser usados são quase sempre agentes quelatantes, sendo o reagente mais comum o sal dissódico do ácido etilenodiaminotetracético (EDTA). Quase todos os metais podem ser titulados pelo EDTA ou reagentes semelhantes, e essas titulações representam um dos maiores desenvolvimentos da química analítica clássica nos últimos anos.
Titulação sem indicador:
O ponto de equivalência é indicado pelo aparecimento de uma turbidez. Esse é um dos métodos mais precisos de análise volumétrica para a determinação da prata. A determinação é feita pela adição de uma solução-titulada de NaCl ou NaBr, e a suspensão é agitada até que haja coagulação do AgBr ou AgCl formado.
A velocidade de coagulação é uma indicação da proximidade do ponto de equivalência, pois quanto menor a concentração de íons prata na solução, menor a carga positiva nas partículas do precipitado. O precipitado é deixado em repouso para depositar e, então, um pequeno volume da solução-titulada, diluída dez vezes, é adicionada à solução, cuja fase líquida estará perfeitamente límpida.
Qualquer resto de íon prata na solução dará turbidez. Se essa turbidez for forte, a solução será novamente agitada para coagulação, e o processo repetido até que se tenha fraca ou nenhuma turbidez.
Por: Renan Bardine
Veja também:
- Ácidos e Bases
- Oxidação e Redução
- Estudo da Volumetria de Neutralização
- Análise Titrimétrica – Acidez e Alcalinidade