Pontes de hidrogênio, ligação química caracterizada por uma ligação covalente entre o hidrogênio e uma ligação covalente com o oxigênio (O), nitrogênio (N) ou flúor (F), e uma interação do tipo dipolo-dipolo entre o átomo de hidrogênio e um átomo de oxigênio (O), nitrogênio (N) ou flúor (F). Por exemplo, a molécula de água pode formar ligações do tipo ponte de hidrogênio cuja representação é:
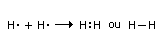
A linha contínua indica a ligação covalente, e a linha tracejada, a ligação gerada pela interação entre os dipolos elétricos presentes no oxigênio e no hidrogênio. Os três átomos envolvidos em uma ligação desse tipo, que podemos representar genericamente por:
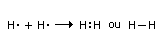
podem ser unidos por uma linha reta. Entretanto, ângulos AHB de até 30° já foram medidos.
Ligação covalente ou molecular ou homopolar, tipo de ligação química responsável pela coesão molecular. A principal característica da ligação covalente é o compartilhamento de um par de elétrons de valência pelos átomos que formam a molécula. Por exemplo, na molécula de hidrogênio (H2), os dois núcleos de hidrogênio compartilham os dois elétrons de valência. Uma ligação covalente como a do H2 é representada por uma estrutura chamada estrutura de Lewis, formulada pelo químico norte-americano Gilbert Newton Lewis (1875-1946)
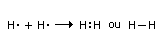
onde o ponto representa um elétron. Os dois elétrons compartilhados são representados pelos dois pontos ou pela linha. Átomos com muitos elétrons também formam ligações covalentes. Por exemplo, a configuração eletrônica do flúor (F) é 1s22s22p5. O orbital 1s está totalmente preenchido, mas o orbital 2s tem um elétron não-pareado. Na molécula de flúor (F2), os dois elétrons não-pareados, um de cada átomo, formam a ligação covalente.
Forças ou ligações de Van der Waals, um dos tipos de forças intermoleculares, caracterizadas por existirem entre moléculas eletricamente neutras. Foram descobertas pelo físico holandês Johannes van der Waals. Dividem-se em (a) forças de van der Waals do tipo dipolo-dipolo, responsáveis pela interação entre duas moléculas que possuem momento de dipolo elétrico permanente, isto é, são moléculas polares; (b) forças de van der Waals do tipo polarizabilidade-polarizabilidade, responsáveis pela interação entre duas moléculas que apresentam momento de dipolo elétrico instantaneamente induzido, isto é, são moléculas polarizáveis; (c) forças de van der Waals do tipo dipolo-polarizabilidade, responsáveis pela interação entre uma molécula que apresenta momento de dipolo elétrico permanente e outra que apresenta momento de dipolo induzido.
Forças intermoleculares, forças de atração e repulsão entre as moléculas.
As forças de atração ou de Van der Waals são as responsáveis por muitos fenômenos físicos e químicos, como a adesão, o atrito e a viscosidade. Mais complexo, o fenômeno das forças repulsivas ainda não é completamente conhecido, mas pode ser observado normalmente entre moléculas que não interagem quimicamente.
Van der Waals, Johannes Diderik (1837-1923), físico holandês que desenvolveu uma teoria sobre a continuidade dos estados líquido e gasoso da matéria que se expressa na equação van der Waals. Por estas descobertas recebeu em 1910 o Prêmio Nobel de Física.
Por: Paulo Magno da Costa Torres
Veja também:
- Ligações Químicas
- Hidrogênio
- Forças Intermoleculares – Exercícios
- Solubilidade
- Reações de Oxidação – Exercícios