A maioria das substâncias sólidas são solúveis ao menos em um líquido. Muitas dissolvem-se em um número bastante grande de solventes, de maneira mais ou menos fácil. Essa propriedade de os compostos se dissolverem com maior ou menor facilidade é chamada coeficiente de solubididade. Apesar de não existir nenhuma substância que seja totalmente insolúvel em relação a qualquer líquido, existem algumas que se mostram praticamente insolúveis. Esse comportamento diferente que apresentam em relação a um mesmo solvente pode ser usado para fazer a separação de várias substâncias presentes em uma mistura, por meio de um método muito simples – a recristalização.
Purificação por recristalização:
O produto obtido de uma reação química, na maioria das vezes, encontra-se no estado impuro, e é necessário purificá-lo. Quando se dissolve uma substância sólida num solvente, a quente, e depois, por resfriamento, obtém-se novamente o estado cristalino, este processo chama-se recristalização. O composto a ser purificado deve ser solúvel num solvente (ou mistura de solventes) a quente, e de pequena solubilidade a frio. Se a impureza for insolúvel a quente, separa-se a mesma por filtração da mistura aquecida. No caso oposto, ou seja, se a impureza for solúvel a frio, o composto passa ao estado sólido, deixando as impurezas em solução. O difícil é a escolha do solvente ideal, isto é, o meio cristalizante. A solubilidade do composto num certo solvente pode ser encontrada em manuais de laboratório ou então por experimentação: Adiciona-se pequenas amostras do material em tubos de ensaio contendo diferentes solventes e aquecendo-os em banho-maria até a fervura, verificando a solubilidade em cada um.
Feito o aquecimento da mistura, o próximo passo é a filtração a vácuo da solução, obtendo-se a substância purificada em solução e retendo as impurezas no filtro. Dá-se preferência à filtração a vácuo por ser esta mais eficaz e mais rápida do que a filtração comum, além de fornecer um sólido com baixo grau de umidade. O frasco contendo a solução da substância pura é então resfriada, de modo a cristalizar o soluto. Algumas cristalizações não ocorrem espontaneamente, devido à tendência de certos compostos a formarem soluções supersaturadas. Neste caso é necessário adicionar à solução alguns cristais do composto ou atritar as paredes do frasco provocando ranhuras no vidro, para que se desprendam minúsculos fragmentos deste, que servirão de ponto de apoio para a formação dos cristais do soluto.
Em seguida, após a cristalização do soluto, faz-se nova filtração, ficando agora retidos os cristais da substância pura e deixando passar a água. Veja o esquema a seguir:

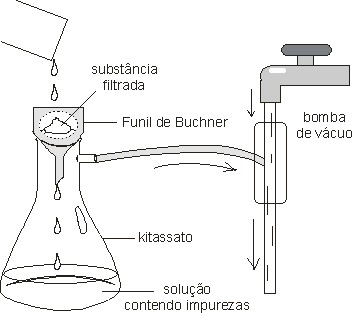
Durante a filtração, tape algumas vezes a boca do funil para acelerar o processo. A bomba de vácuo retira o ar de dentro do kitassato, diminuindo a pressão em seu interior. Como a tendência dos gases é de migrar de uma região de maior pressão para a de menor pressão, o ar que está do lado de fora é fortemente “sugado” para dentro do kitassato, “empurrando” consigo grande parte da água contida no material filtrado.
Não é possível recuperar 100% da substância que se quer purificar, pois sempre há perdas durante o processos envolvidos na purificação. O rendimento na obtenção da subtância pura depende dos coeficientes de solubilidade dos componentes da mistura, da quantidade de cada um e da habilidade do operador.
Para se purificar uma substância pelo método de recristalização resulta em muitas perdas. Perdas estas que podem ser reduzidas, dependendo da habilidade do operador e dos coeficietes de solubilidade dos compostos utilizados.
Conclusão
Através dos experimentos realizados nesta prática concluímos que a purificação através de recristalização é um método de retirar as impurezas de um composto e que há um baixo rendimento percentual devido ás perdas ocorridas durante os experimentos.
Bibliografia
Site: www.geocities.com/Vienna/Choir/9201/recristalizacao.htm
Livro: Vogel, Artur . I. – Química Orgânica, Análise Orgânica Qualitativa, vol.1, 3ª edição, R.J. 1979.
Autoria: Bruno Magalhães Alexandre