Através da aplicação das propriedades coligativas, é possível se determinar as massas moleculares. Em muitos casos as propriedades de uma solução podem ser consideradas como sendo as do solvente puro, modificadas pela presença das moléculas do soluto.
Nestes casos o efeito sobre as propriedades do solvente depende do número de moléculas do soluto presentes, numa certa quantidade de solvente e não das propriedades específicas do soluto. Assim as alterações nos pontos de fusão (ou congelamento), ebulição e pressão de vapor de uma solução, depende principalmente do número de partículas implicadas.
Entendendo o que são as propriedades coligativas
O entendimento das propriedades coligativas, além de ajudar os estudantes de química, também ajuda a responder questões de rotina, amplamente conhecidas por várias pessoas que, aparentemente, não sabem o motivo pelo qual algumas dessas coisas ocorrem.
O fato de as águas do oceano não congelarem em temperaturas baixíssimas, o hábito de adicionar sal ao gelo para gelar latas de certa bebida ou o motivo pelo qual o ponto de ebulição da água (por exemplo) muda quando é misturada com ela certa quantidade de sal ou açúcar. Esses são exemplos de algumas questões que podem ser respondidas com o devido entendimento das propriedades coligativas.
Mas, afinal, quais são as propriedades coligativas?
Existem quatro propriedades coligativas diferentes: Tonoscopia (ou Tonometria), Ebuliometria, Criometria e Osmometria. As três primeiras foram estudadas pelo cientista francês François Marie Raoult, enquanto a quarta (Osmometria) teve seus estudos feitos por um químico neerlandês chamado Jacobus Henricus Van’t Hoff.
Abaixo, veremos detalhadamente cada uma das quatro propriedades coligativas.
Tonoscopia (ou Tonometria):
Entende-se que tonoscopia, tecnicamente falando, é o que estuda os efeitos do abaixamento da pressão de vapor máxima de certo líquido, cujo responsável é uma solução não-volátil adicionada à solução.
Em uma solução, quanto maior for o número de mols do soluto, menor será a pressão máxima de vapor dessa solução.
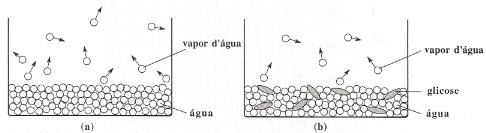
A velocidade de evaporação da água (a) diminui quando lhe adicionamos glicose (soluto não-volátil) (b).
Tonometria é a medida do abaixamento da pressão vapor de um solvente volátil, provocado por adição de um soluto não-volátil
Ebuliometria:
Pode-se dizer que a ebuliometria é a propriedade que estuda a elevação da temperatura de ebulição do solvente graças à adição de um soluto.
A quantidade do soluto depositada na solução é o que vai determinar o nível de aumento que haverá no ponto de ebulição.
Quando a água ferve com a adição de açúcar é um exemplo perfeito dessa propriedade.
Ebuliometria é a medida da elevação da temperatura de ebulição de um solvente volátil, provocada por adição de um soluto não-volátil
Criometria:
Ao contrário da propriedade anterior, a criometria estuda as questões da diminuição da temperatura de solidificação de uma solução, quando nela é adicionado um soluto.
Exemplo: a água poluída possui ponto de solidificação menor que o da água limpa. Isso acontece pelo fato de a primeira opção possuir partículas não-voláteis que a segunda não possui. Isso dificulta ainda mais o seu congelamento.
Criometria é a medida do abaixamento da temperatura de congelamento de um solvente volátil, provocada por adição de um soluto não-volátil
Osmometria:
A osmometria, por sua vez, é conhecida por estudar o surgimento da pressão osmótica nas soluções. Esse aumento acontece quando ocorre a separação de duas soluções com o mesmo solvente através de uma membrana semipermeável, que faz com que o resultado apresente duas soluções com a mesma concentração. (Osmose)
Um exemplo de rotina dessa propriedade são as conservas.
Vídeo:
Assista a uma vídeo-aula sobre o assunto em nosso canal do Youtube
Por: Marco Aurélio Fagundes