01. Forneça a ordem crescente de pontos de ebulição das substâncias com fórmulas:
H3C – CH2 – OH CH4 CH3 – CH3
(I) (II) (III)
02. (FRANCISCANA) Quando a substância hidrogênio passa do estado líquido para o estado gasoso, são rompidas:
a) ligações de Van der Waals
b) pontes de hidrogênio
c) ligações covalentes e pontes de hidrogênio
d) ligações covalentes apolares
e) ligações covalentes polares
03. (FEI) Qual o tipo de interação que se manifesta:
a) entre moléculas NH3 (l)?
b) entre moléculas CH4 (l)?
04. (ABC) Entre as moléculas abaixo, a que forma pontes de hidrogênio entre suas moléculas é:
a) CH4
b) CH3 – CH2 – OH
c) CH3 – O – CH3
d) C2H6
e) N(CH3)3
05. (UBERLÂNDIA) Identifique a substância que deve possuir maior ponto de ebulição, entre as apresentadas abaixo:
a) Cl2
b) C2H6
c) H3C – CH2 – CH2 – COOH
d) H2C = CH – CH3
e) H3C – CH2 – CH2 – CH3
Os testes n.º 06 e n.º 07 referem-se ao gráfico:
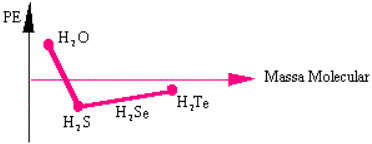
06. A água tem maior ponto de ebulição, porque apresenta:
a) molécula com 10 elétrons
b) geometria angular
c) hibridação sp3
d) ligações por pontes de hidrogênio
e) ligações do s – p
07. H2Te tem maior P.E. que H2S porque possui:
a) geometria angular
b) maior massa
c) ligações tipo dipolo-dipolo
d) ligações por pontes de hidrogênio
e) ligações do tipo s – p
08. (FEI) Qual o tipo de ligação responsável pelas atrações intermoleculares nos líquidos e sólidos constituídos de moléculas apolares?
09. (SANTA CASA) Abaixo estão esquematizadas, por linhas pontilhadas, ligações entre moléculas. Qual delas tem maior probabilidade de ocorrer?
a) F – H … F – H
b) F – H … H – F
H
\
c) O ….. F – H
/
H
H H
\ /
d) O ….. O
/ \
H H
H
/
e) O ……. H – F
\
H
10. (PUC) As pontes de hidrogênio aparecem:
a) quando o hidrogênio está ligado a um elemento muito eletropositivo;
b) quando o hidrogênio está ligado a um elemento muito eletronegativo;
c) em todos os compostos hidrogenados;
d) somente em compostos inorgânicos;
e) somente nos ácidos de Arrhenius.
Respostas:
01. I: apresenta maior ponto de ebulição, pois as moléculas unem-se por pontes de hidrogênio.
II e III: moléculas apolares, unem-se por forças de Van der Vaals do tipo dispersões de London. A substância III deve possuir ponto de ebulição mais alto que II, por ter moléculas maiores.
Logo, temos: II < III < I
02. A
03. a) Ponte de hidrogênio
b) Dispersões de London
| 04. B | 05. C | 06. D | 07. B |
08. Forças de Van der Walls, do tipo Dispersões de London.
| 09. A | 10. B |