Desejando comparar a dificuldade para esquentar ou para esfriar não apenas de vários corpos entre si, mas, de uma maneira mais geral, das substâncias que os constituem, define-se uma nova grandeza, que será chamada de calor específico.
Essa grandeza permitirá responder a questões do tipo: quem tem maior dificuldade para esquentar (ou esfriar), o vidro ou o plástico?, sem a preocupação com tamanhos ou dimensões, mas apenas com as substâncias a serem comparadas.
Para obter o calor específico de uma substância, basta medir a capacidade térmica de uma amostra arbitrária da substância que se deseja analisar e compará-la com a sua massa. Assim, indicando o calor específico dessa amostra por c, a sua capacidade térmica por X e a massa por m, tem-se:
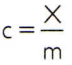
Essa relação tem uma propriedade interessante: se a massa da amostra aumentar, exatamente na mesma proporção aumentará a sua capacidade térmica e, portanto, o calor específico correspondente não será alterado. Dessa forma, tanto faz calcular o calor específico do volume de água de uma colher, de um balde, de uma piscina ou de um oceano. Em todas essas situações, obtém-se 4.186,8 J/kg • K (que, de acordo com as normas do SI, deve ser lido como “4.186,8 joules por quilograma e por Kelvin”), ou seu valor equivalente: 1 cal/g • °C
Essa mesma relação ainda permite uma releitura puramente matemática do conceito de calor específico, que, nesses termos, deixa de ser uma forma de avaliar a dificuldade para aquecer um dado material e passa a ser “A quantidade de calor, em joules ou em calorias, necessária para aquecer 1 kg ou 1 grama da substância de 1 K ou de 1 °C“.
Tabela
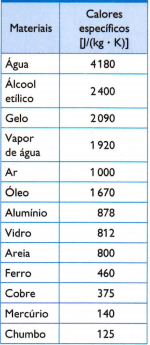
Na tabela ao lado, há alguns dos calores específicos usuais, obtidos medindo-se cuidadosamente a massa da amostra do material em estudo, a quantidade de calor usada (medida por meio da massa de combustível queimada) e a variação de temperatura resultante (medida com um termômetro de boa qualidade).
Fórmula do calor específico
As definições de calor específico e de capacidade térmica, aliadas a tabelas como a indicada anteriormente, permitem medir quantidades de calor por meio de uma relação matemática simples. Para obter essa relação, é preciso relembrar a definição de calor específico, substituindo nela a capacidade térmica pela sua respectiva definição, isto é, adotando a escala Celsius para medir as temperaturas:
O que, na escala de temperatura termodinâmica, é indicado como:
Q = m • c • ΔT
Nessa expressão, Q representa a quantidade de calor que se deseja calcular; m, a massa do corpo; c, o calor específico do material que constituí o corpo, e Δθ, a variação de Temperatura causada no corpo.
Note que Δθ ou ΔT são variações de temperaturas e, portanto, correspondem ao valor da Temperatura final subtraída da inicial.
Exercícios resolvidos
1) Usando o valor do calor específico da água indicado na tabela, calcule quanto calor é necessário para aumentar de 25 °C, ou de 25 K, a temperatura de 3 kg de água.
Solução:
Substituindo na relação: Q = m • c • AT cada termo pelo seu valor indicado no enunciado, obtém-se:
Q = 3 • 4180 • 25 => Q = 313 500 J
2) No interior de uma garrafa térmica, são introduzidas três amostras: uma de 0,5 kg de alumínio a 523 K, outra de 1,0 kg de ferro a 463 K e uma terceira de 1,5 kg de chumbo a 368 K.
De acordo com os calores específicos fornecidos na tabela, determine a temperatura de equilíbrio térmico que o conjunto das três amostras adquire após algum tempo.
Despreze a quantidade de calor trocada com a garrafa térmica e as eventuais trocas de calor com o ambiente.
Solução:
Nas condições descritas no enunciado, a amostra de alumínio, por ser a mais quente das três, certamente vai ceder calor às outras duas, e a de chumbo, por ser a mais fria, vai recebê-lo. O problema está em determinar o comportamento do ferro.
O ferro, estando a uma temperatura menor que a do alumínio, deverá, de fato, receber calor deste, mas, estando mais quente que o chumbo, deverá ceder calor ao chumbo. Assim, o ferro receberá mais calor do que cederá ou, ao contrário, cederá mais calor do que receberá!
Usando o Principio da Conservação da Energia, que nesse caso se reduz ao da Conservação da Energia Térmica, determina-se que
Q alumínio + Q Ferro + Q chumbo = 0
Observe que essa igualdade corresponde a afirmar que algumas das amostras poderão perder calor, numa quantidade de —x joules, por exemplo. Como, porém, o total de energia deverá se conservar, outras amostras deverão receber uma quantidade equivalente de +x joules, levando, assim, a soma dos calores trocados ao valor 0, quaisquer que sejam os corpos que cedam ou que recebam essa quantidade de calor.
Substituindo, então, cada uma das parcelas dessa última igualdade pelo respectivo produto m • c • ΔT, obtém-se:
0,5 • 878 • (Tf – 523) + 1 • 460 • (Tf – 463) + 1,5 • 125 • (Tf – 368) = 0
Assim, realizadas as operações indicadas, chega-se a:
Tf ≅ 470,8 K ou Tf ≅ 197,8 °C.
Por: Paulo Magno Torres