À medida que o número de elementos químicos conhecidos aumentava, fazia-se necessário relacioná-los de maneira racional. Assim, surgiu a Tabela Periódica.
Na tabela periódica atual, os elementos químicos (são conhecidos pouco mais de cem elementos) estão organizados:
- em linhas horizontais, chamadas períodos, nas quais se colocam os elementos em ordem crescente de números atômicos;
- em linhas verticais, chamadas grupos ou famílias, nas quais se colocam os elementos de propriedades semelhantes.
Essa ordem faz com que a tabela seja um instrumento indispensável para o estudo da Química, uma vez que muitas propriedades dos elementos químicos estão intimamente ligadas à sua posição no sistema periódico.
Tipos de elementos
Os elementos que estão no último grupo do sistema periódico são denominados gases nobres ou gases inertes (nas condições ambientes, são encontrados no estado gasoso). Esses elementos são estáveis e não reagem com outros e por isso são chamados “nobres”.
Os elementos que estão à esquerda e no centro são chamados metais e praticamente todos são sólidos em condições ambientes [com exceção do mercúrio (Hg), que é líquido].
Os que estão entre os metais e os gases nobres são denominados não-metais e podem ser encontrados nos três estados físicos nas condições ambientes: sólido [por exemplo: iodo (I)], líquido [por exemplo: bromo (Br)] e gasoso [por exemplo: oxigênio (O)].
Os elementos que estão junto à linha grossa, que separa os metais e os não-metais, são chamados metais de transição ou metaloides, uma vez que apresentam propriedades intermediárias entre as metálicas e as não-metálicas.
Os elementos que estão na parte inferior da tabela são chamados elementos de transição interna. A primeira linha é a dos lantanídeos e a segunda, a dos actinídeos
Famílias ou grupos
Cada coluna vertical da Tabela Periódica constitui o que chamamos família ou grupo de elementos; são ao todo, dezoito.
Uma família corresponde a elementos que apresentam certa similaridade na sua estrutura eletrônica da última camada, o que acarreta certa semelhança de comportamento químico.
Os átomos de uma família apresentam:
- a mesma configuração eletrônica na última (camada de valência);
- propriedades químicas semelhantes.
Grupo 1. Metais alcalinos: lítio (LI), sódio (Na), potássio (K), rubídio (Rb), césio (Cs) e frâncio (Fr).
Grupo 2. Metais alcalino-terrosos: berílio (Be), magnésio (Mg), cálcio (Ca), estrôncio (Sr). bário (Ba) e rádio (Ra).
Grupo 13. Família do boro boro (B), alumínio (Al), gálio (Ga), índio (In) e tálio (TI).
Grupo 14. Família do carbono: carbono (C), silício (Si), germânio (Ge), estanho (Sn) e chumbo (Pb).
Grupo 15. Família do nitrogênio: nitrogênio (N), fósforo (P), arsênio (As), antimônio (Sb) e bismuto (Bi).
Grupo 16. Calcogênios: oxigênio (O), enxofre (S), selênio (Se), telúrio (Te) e polônio (Po).
Grupo 17. Halogênios: flúor (F), cloro (Cl), bromo (Br), iodo (1) e astato (At).
Grupo 18. Gases nobres: hélio (He), neônio (Ne), argônio (Ar), criptônio (Kr), xenônio (Xe) e radônio (Rn).
Do grupo 3 ao grupo 12. Elementos de transição. Alguns exemplos: crômio (Cr), ferro (Fe), níquel (Ni), cobre (Cu), zinco (Zn), prata (Ag), platina (Pt), ouro (Au) e mercúrio (Hg). Uma irregularidade sem solução, ainda que sem muita importância, é a posição do hidrogênio (H). Há químicos que o consideram pertencente ao grupo 1, dos metais alcalinos. Outros dizem que poderia situar-se no grupo 17, com os halogênios. Há ainda aqueles que não o incluem em grupo algum.
Nas configurações acima, n é o número do nível da última camada (camada de valência).
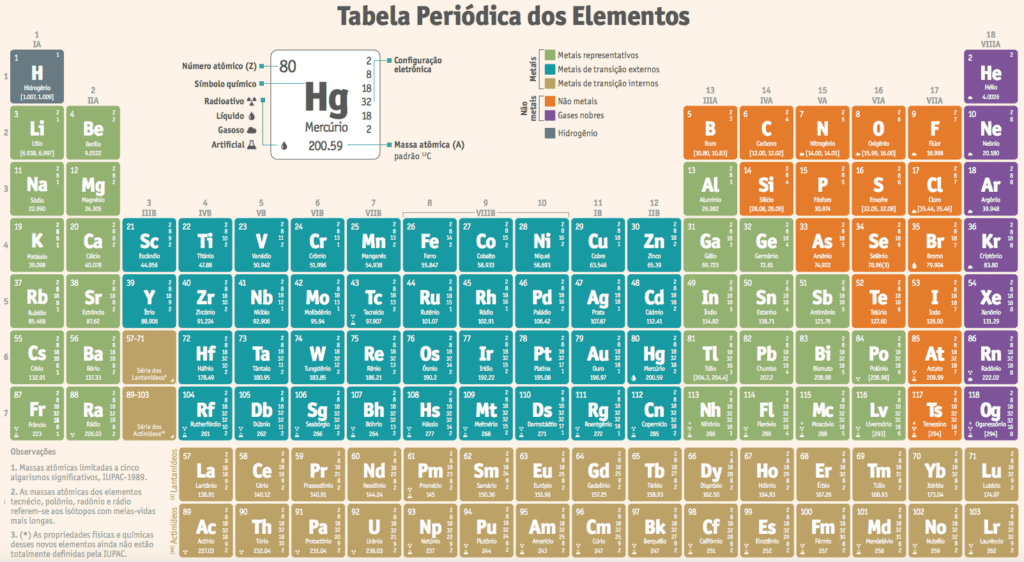
Clique para ver a tabela em tamanho real
Períodos ou séries
Cada fila horizontal da tabela periódica constitui o que chamamos período ou série de elementos.
Cada período corresponde ao número de camadas eletrônicas existentes nos elementos que o constituem. Os períodos são sete (7).
Período | Camadas eletrônicas |
| 1 | 1 (K) |
| 2 | 2 (K, L) |
| 3 | 3 (K, L, M) |
| 4 | 4 (K, L, M, N) |
| 5 | 5 (K, L, M, N, O) |
| 6 | 6 (K, L, M, N, O, P) |
| 7 | 7 (K, L, M, N, O, P, Q) |
Vejamos alguns exemplos de localização na tabela periódica.
- 11Na = 1s2 2s2 2p6 3S1 3º período → 3 camadas
K=2 L=8 M=1 Família IA → 1 e– na camada de valência - 9F = 1s2 2s22p5 2º período → 2 camadas
K=2 L=7 Família VIIA → 7 e– na camada de valência
Série dos Lantanídeos e dos Actinídeos
É o nome que recebem os dois apêndices embaixo da tabela.
Observações
a) Lantânio (La) e Actínio (Ac) não pertencem às séries.
b) Essas séries são chamadas Elementos de Transição Interna.
c) Os lantanídeos também são chamados lantanoides ou terras-raras.
d) Os actinídeos também são chamados actinoides.
e) O uso dos termos “lantanoide” e “actinoide” foi recomendado pela IUPAC.
Classificações dos elementos químicos
Uma outra classificação pode ser feita relacionando o subnível mais energético de cada elemento.
Assim temos:
| Elementos | Subnível mais energético | Localização |
| Representativos | s ou p | Grupos A e gases nobres |
| De transição | d | Grupos B |
| De transição interna | f | Lantanídeos e Actinídeos |
Veja também:
- A História da Tabela Periódica
- Propriedades Periódicas dos Elementos
- Número Atômico e Número de Massa
- Distribuição Eletrônica