O é um dos elementos químicos da tabela periódica. Sua massa é 32 u, sendo esse “u” o Dalton, medida de massa atômica. Seu número atômico é 16. O enxofre é encontrado em estado sólido na temperatura ambiente, que corresponde a 25 graus Celsius.
Apesar de popularmente se dizer que o enxofre possui cheiro, ele é um elemento insípido e inodoro, ou seja, que não tem gosto nenhum. O cheiro que se associa ao enxofre, na verdade, vem de seus compostos, como o Sulfeto de hidrogênio.
O enxofre também é um não-metal: ele não conduz eletricidade, mas que pode agir como um semicondutor ou como um isolador. Ele apresenta forma de cristais de cor amarela e tem grande importância para os organismos vivos, uma vez que está presente nos aminoácidos.
É possível encontrar o enxofre em vários produtos, sendo muito comum em inseticidas, detergentes, sabão em pó, palitos de fósforo, laxantes, pólvora e fertilizantes. Além disso, o enxofre é utilizado no processo de formação do ácido sulfúrico para baterias.
O processo de obtenção de enxofre em laboratórios não é usual, pois esse é um elemento encontrado com grande facilidade na natureza. É possível encontrar o enxofre em meteoritos, fontes de águas termais e em regiões próximas a vulcões. É estimado que sua presença na crosta terrestre seja de 0,3%.

Apesar do seu uso na indústria, o enxofre também tem um grande papel na área biológica. Ele pode ser encontrado em alimentos como aspargos, cebolas, queijos, peixes e inclusive nas gemas dos ovos. Porém, não há motivo para preocupação, pois o enxofre não é tóxico e seu excesso é eliminado pelo corpo através da urina. Além disso, ele faz bem ao organismo: sua falta ocasiona problemas de crescimento.
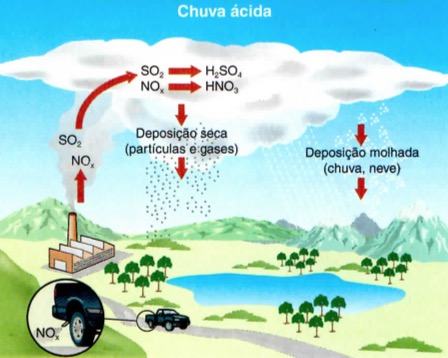
Há algumas precauções a se tomar com relação aos componentes do enxofre. O dióxido de enxofre deve ser manuseado com muito cuidado, sendo bastante tóxico. Ele atua na atmosfera e, por essa reação, ocorre a chuva ácida. Se estiver em quantidades muito altas, pode provocar hemorragia e asfixia, por deixar os pulmões cheios de sangue.
Métodos de obtenção:
O enxofre é conhecido desde a Antiguidade. Foi usado pelos alquimistas na tentativa de transformar metais em ouro.
Substâncias contendo enxofre são encontradas perto de vulcões, em fontes de águas quentes, no petróleo e no gás natural.
O enxofre tem uma cor amarelada, é inodoro e, no estado sólido, é quebradiço. Ao entrar em combustão, produz o dióxido de enxofre (S02). Em condições normais, não reage com água.

O enxofre de natureza sedimentar pode ser obtido por aquecimento do minério em fornos especiais, que se volatiliza e é, então, recolhido em câmaras de sublimação. Esse tipo de enxofre é encontrado em minas na Sicília (Itália).
Um outro processo para a obtenção do enxofre destina-se àqueles que se encontram em formações profundas e foi desenvolvido por Herman Flasch.
O método de Flasch consiste em cavar poços e introduzir nas rochas tubos concêntricos. No tubo exterior, é injetada água quente com o intuito de fundir o enxofre. Em um outro tubo de menor diâmetro, o ar é injetado sob forte pressão para forçar o enxofre líquido a subir até a superfície por um terceiro tubo.
As principais substâncias que apresentam enxofre são o sulfeto de hidrogênio (H2S); os polissulfetos de hidrogênio ((H2S)„); o dissulfeto de carbono (CS2); o dióxido de enxofre (S02); o trióxido de enxofre (S03); o ácido sulfúrico (H2S04); o ácido tiossulfúrico (H2S203).
O dióxido de enxofre e o dióxido de nitrogênio -lançados na atmosfera pela queima de carvão e de combustíveis fósseis e pelos poluentes industriais -combinam-se com o hidrogênio presente na atmosfera sob a forma de vapor de água, produzindo ácido sulfúrico e/ou ácido nítrico – é a chuva ácida.
Aplicações

O enxofre é uma das matérias-primas básicas das indústrias químicas. Ele é usado como corante e faz parte da composição de esmaltes, tintas, plásticos, gesso e isolantes elétricos. Sua natureza é inflamável e, por esse motivo, é utilizado como componente de pólvoras, fósforos e artefatos pirotécnicos. Também é empregado na vulcanização de borrachas e na fabricação de inseticidas.
A maior parte do enxofre é usada na produção de ácido sulfúrico empregado em vários ramos da indústria, como no refino de petróleo, na fabricação de baterias de automóveis e na catalise de reações orgânicas.
Em preparados medicinais, o sulfato de magnésio é utilizado como laxante e nutriente para plantas.
Os sulfitos são usados para clarear papéis e como conservantes de vinhos e de frutas secas.
Nome do elemento: Sulphur. Enxofre
Origem do nome: Do latim sulphur. enxofre e/ou do árabe sufra: amarelo.
Descobridor: Foi reconhecido como elemento pelo químico francês Antoine Laurent Lavoisier (1743-1794).
Ano de descoberta: 1777
Número atômico (Z): 16
Massa atômica: 32,0650
Família: 16
Período: 3
Configuração eletrônica: [Ne]3s23p4
Raio atômico: 100 pm
Estado de agregação da substância simples (CNTP): sólido
TE (substância simples): 444,72 °C
TF (substância simples): 115,21 °C
Por: Gabriele Ferreira