Para que uma reação química ocorra, é necessário que as moléculas dos reagentes sejam postas em contato através de um choque. Esse choque precisa ser frequente, intenso e bem orientado, de modo a promover uma interação perfeita entre as moléculas. Mas, além dos choques, é preciso que seja fornecida uma quantidade mínima de energia, que seja capaz de iniciar a reação. Essa quantidade de energia recebe o nome de energia de ativação (Ea).
No instante que ocorre a colisão eficaz, é formada uma estrutura química chamada de complexo ativado, que corresponde a um estágio intermediário, em que há o enfraquecimento das ligações químicas dos reagentes para que novos produtos sejam formados. Se a energia fornecida aos reagentes for menor que a energia de ativação, o complexo ativado não será formado, e, portanto, a reação química não acontecerá.
Para entender melhor a ideia de energia de ativação, podemos representá-la graficamente:
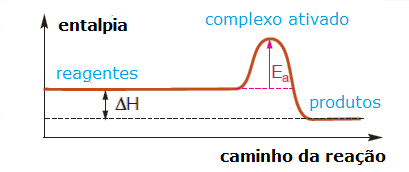
O gráfico mostra a energia dos reagentes e dos produtos em função do decurso da reação. Observe que, embora a energia dos reagentes seja maior do que a energia dos produtos (o que justifica a liberação de energia), é preciso haver o fornecimento de uma quantidade de energia para que os reagentes alcancem a energia de ativação e a reação possa, de fato, ocorrer.
Diferentes reações químicas têm diferentes energias de ativação, que podem ser fornecidas aos reagentes de diversas formas. Veja alguns exemplos:
- Um palito de fósforo só entra em combustão quando o atritamos, assim, a energia de ativação é fornecida através do atrito.
- A energia de ativação necessária para decompor a água oxigenada é fornecida pela luz.
- Uma faísca elétrica fornece a energia de ativação necessária para a explosão da gasolina nos motores dos carros.
- Os airbags, dispositivos de segurança de carros, são acionados a partir de uma reação química, cuja energia de ativação é fornecida através de uma faísca.
- Na fotossíntese, a luz solar fornece a energia necessária para que a reação ocorra.
Numa reação química, podemos dizer que a energia de ativação funciona como uma espécie de barreira energética, que precisa ser transposta para que a reação aconteça efetivamente. Dessa forma, a energia de ativação determina a velocidade com a qual a reação se processa. Quanto menor for a energia de ativação, menor será a barreira a ser ultrapassada e mais rápida será a reação. Por outro lado, quando a energia de ativação é muito alta, maior é a barreira energética e mais lenta será a transformação química.
Existem substâncias que, quando aplicadas às reações químicas, são capazes de criar um caminho alternativo com uma barreira de energia de ativação menor e, como consequência, acelerar o desenvolvimento da reação. Essas substâncias são chamadas de catalisadores. Veja uma comparação no gráfico:
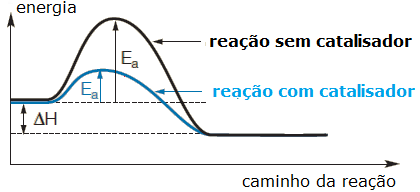
As enzimas são exemplos de catalisadores, elas agem nas reações metabólicas dos organismos vivos, encurtando a barreira da energia de ativação e fazendo com que transformações que demorariam um longo tempo para acontecer possam ocorrer em frações de segundos.
Referências
FELTRE, Ricardo. Química volume 2. São Paulo: Moderna, 2005.
MACHADO, Andrea Horta, MORTIMER, Eduardo Fleury. Química volume único. São Paulo: Scipione, 2005.
USBERCO, João, SALVADOR, Edgard. Química volume único. São Paulo: Saraiva, 2002.
Por: Mayara Lopes Cardoso