Sabemos que muitos elementos químicos não são encontrados isoladamente na natureza, mas sim, combinados com uns com os outros, o que explica a enorme variedade de substâncias existentes. Essa combinação ocorre entre átomos de cada elemento através de perda, ganho ou compartilhamento de elétrons.
A família dos gases nobres, também conhecida como família 0 ou 8A, é uma exceção: os elementos que a compõem estão presentes na natureza sob a forma de átomos isolados e, além disso, são os únicos elementos que apresentam 8 elétrons na última camada eletrônica, salvo o Hélio, que possui apenas duas. Observe:
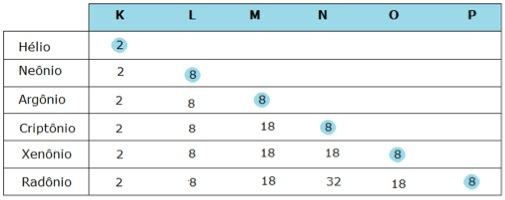
Levando em consideração a configuração eletrônica dos gases nobres, a tendência que muitos elementos apresentam de compartilhar, ceder ou receber elétrons e o fato de os gases nobres não se combinarem quimicamente com outros elementos na natureza, os químicos Gilbert Lewis e Walter Kossel lançaram, em 1916, a hipótese que ficou conhecida como regra do octeto:
Os átomos atingem a estabilidade eletrônica quando alcançam a configuração dos gases nobres, isto é, quando possuem 8 elétrons na camada de valência (última da eletrosfera), ou 2 elétrons quando têm apenas uma camada.
Para entendermos melhor o que propõe a regra do octeto, vamos tomar como exemplo o cloreto de sódio (NaCℓ), mais conhecido como sal de cozinha. O sódio (Na) pertence à família 1A da tabela periódica, logo, possui apenas 1 elétron na última camada eletrônica. O cloro (Cℓ), por sua vez, é um membro da família 7A, portanto, apresenta 7 elétrons na camada de valência. Ao se combinarem quimicamente, o átomo de sódio doa 1 elétron ao átomo de cloro e ambos passam a apresentar 8 elétrons na última camada, adquirindo a configuração eletrônica de um gás nobre.
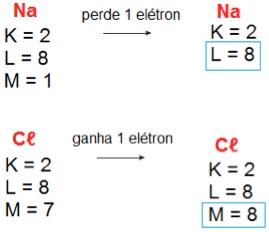
Podemos simplificar isto usando a notação de Lewis, onde os sinais ? representam os elétrons da última camada eletrônica:
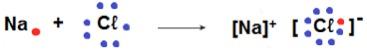
Na prática, porém, a regra do octeto não se aplica a todos os elementos químicos. Para alguns deles, não é necessário apresentar 8 elétrons na última camada para se tornarem estáveis, como, por exemplo:
- o alumínio (Aℓ) e o boro (B) formam compostos com três ligações simples, portanto, precisam apenas de 6 elétrons na última camada alcançar a estabilidade eletrônica;
- o berílio (Be) dá origem a substâncias com duas ligações químicas simples, por isso, se estabiliza somente com 4 elétrons na camada de valência.
Há casos, ainda, de elementos que precisam de mais de 8 elétrons para adquirir estabilidade, como é o caso do fósforo (P), que se estabiliza com 10 elétrons na última camada, e do enxofre (S) com 12 elétrons. Esse fato também é comum entre lementos de transição (família B).
Apesar de existirem algumas exceções à regra do octeto, tal teoria ainda é muito relevante, principalmente por ajudar na compreensão dos conceitos de ligação química entre átomos e por explicar a formação de grande parte das substâncias presentes na natureza.
Referências bibliográficas
FELTRE, Ricardo. Química volume 1. São Paulo: Moderna, 2005.
MACHADO, Andrea Horta, MORTIMER, Eduardo Fleury. Química volume único. São Paulo: Scipione, 2005.
USBERCO, João, SALVADOR, Edgard. Química volume único. São Paulo: Saraiva, 2002.
Por: Mayara Lopes Cardoso