Na presença de bases fortes, os álcoois atuam como doadores. Os álcoois são geralmente ácidos ligeiramente mais fracos do que a água, com valores de pKa entre 16 e 18. Os álcoois são compostos versáteis, e podem ser usados como material de partida para a preparação de uma grande variedade de compostos.
Oxidação de álcoois a compostos carbônicos
A oxidação de álcoois pode dar origem a um aldeído, uma cetona, ou um ácido carboxílico, dependendo do álcool, do agente oxidante e das condições da reação. Normalmente usam-se compostos de Cr (VI) como oxidantes. A reação de um álcool primário com ácido crômico (preparado por acidificação de soluções de cromato, CrO42-, ou dicromato, Cr2O72-) dá origem principalmente ao ácido carboxílico correspondente:
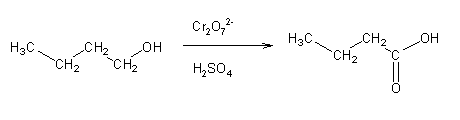
Para se oxidar um álcool primário apenas até ao estado de aldeído não se pode usar ácido crômico, pois este é um oxidante muito forte. Em vez deste, usam-se outras espécies de Cr (VI) (por exemplo clorocromato de piridínio – PCC – ou dicromato de piridínio – PDC) em solução anidra.
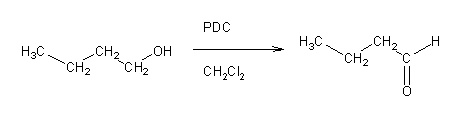
Os álcoois secundários são oxidados a cetonas pelos mesmos reagentes que oxidam os álcoois primários:
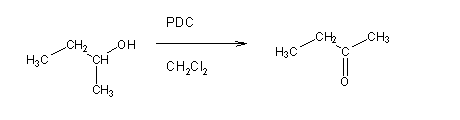
Os álcoois terciários, por não possuírem hidrogênio ligado ao carbono hidroxilado, não são facilmente oxidados.
Os álcoois podem ser classificados de duas maneiras:
– De acordo com o número de hidroxilas:
- 1 hidroxila – monoálcool ou monol
- 2 hidroxilas – diálcool ou diol (também chamado glicol)
- 3 hidroxilas – triálcool ou triol
- Várias hidroxilas – poliálcool ou poliol
– Quanto à posição da hidroxila:
- OH em carbono primário – álcool primário
- OH em carbono secundário – álcool secundário
- OH em carbono terciário – álcool terciário.
Propriedades físicas
As moléculas dos álcoois, por possuírem o grupo polar OH, pode-se dizer, são ligadas entre si pelos mesmos tipos de forças intermoleculares que agregam as moléculas de água umas às outras – as ligações de hidrogênio. Por essa razão é possível misturar as duas substâncias. Isso, no entanto, verifica-se apenas nos álcoois mais simples (metanol, etanol e propanol). Nesses álcoois, que são líquidos incolores voláteis e de cheiro característico, o grupo OH constitui importante porção da molécula. Com o aumento da cadeia carbônica, todavia, o grupo OH começa a perder importância, pois a maior parte da molécula é um hidrocarboneto. Os álcoois então se tornam mais viscosos, menos voláteis e menos solúveis em água, até chegarmos em álcoois de massa molecular tão elevada que são sólidos e insolúveis em água. A viscosidade e a solubilidade dos álcoois em água também aumenta se o número de hidroxilas aumentar. Quanto maior o número de grupos OH, mais intensas serão as interações intermoleculares e maior serão os pontos de fusão e ebulição dos álcoois.
O etanol, em especial, quando misturado com a água na proporção de 95% de álcool e 5% de água, forma com esta uma mistura azeotrópica ou azeótropo. Isto significa que não é possível concentrar o álcool além de 95% através da destilação fracionada. Esta mistura comporta-se como um composto puro, sendo praticamente impossível separar os dois componentes. O álcool puro, chamado álcool absoluto, é muito mais caro e utiliza-se apenas quando estritamente necessário. O etanol a 95% em água tem PE = 78,15o C, inferior aos pontos de ebulição de seus componentes (etanol = 78,3o C e água = 100o C). Os azeótropos que possuem PE superior aos de seus componentes são chamados misturas de ponto de ebulição máximo.
Se o álcool a 95% não se pode concentrar mais por destilação, como é que se obtém o álcool etílico a 100% que também se encontra à venda e que se conhece por álcool absoluto? Tirando partido da existência de outra mistura azeotrópica. Esta, porém, com três componentes (azeótropo ternário). A mistura do 7,5% de água, 18,5% de etanol e 74% de benzeno é azeotrópica e tem ponto de ebulição 64,9o C (mistura de ponto de ebulição mínimo). Vejamos o que acontece se destilarmos uma mistura que contenha, por exemplo, 150 g de etanol a 95% (142,5 g de álcool e 7,5 g de água) e 74 g de benzeno. O primeiro material a destilar é o azeótropo ternário; onde destilarão 100 g, o que corresponde a 7,5 g de água, 18,5 g do álcool e 74 g do benzeno. Quer dizer, toda a água e todo o benzeno, mas apenas parte do álcool destilarão; permanecendo 124 g do álcool puro anidro. Na prática, é comum juntar-se um pouco mais de benzeno do que o estritamente necessário. O excesso é removido, depois da destilação da mistura ternária, como azeótropo binário com álcool (PE = 68,3o C). O caso do álcool etílico demonstra que os azeótropos embora, por vezes, bastante inconvenientes podem frequentemente ser utilizados com vantagem prática. Para certos fins especiais tem de se remover mesmo o mais leve vestígio de água que possa ainda existir no álcool absoluto comercial. Consegue-se isto por tratamento do álcool com magnésio metálico; a água é transformada em Mg (OH)2 insolúvel, e o álcool é então destilado.
Métodos de obtenção
Normalmente, os álcoois não parecem livres na natureza. Entretanto, eles são muito abundantes na forma de ésteres, tanto no reino vegetal quanto no reino animal. Além disso, o álcool etílico é obtido em grande escala por processos de fermentação de açúcares.
Os principais métodos de obtenção dos álcoois são:
- Hidratação de alcenos
- Hidratação de cicloalcenos
- Oxidação branda de alcenos
- Hidratação de epóxidos
- Reação de aldeídos ou cetonas com reagente de Grignard
- Reação de éteres com HX
- Hidrólise de ésteres
Propriedades químicas
O grupo OH dos álcoois é a sua parte mais reativa, e estes compostos podem reagir de duas maneiras: rompendo a ligação O-H ou rompendo a ligação C-OH. Neste último caso, sendo o grupo OH um péssimo abandonador, ou seja, difícil de se retirar de uma molécula, geralmente utiliza-se protonar o grupamento, para facilitar a sua saída. Estudando o comportamento químico dos álcoois, pode-se conhecer muito do comportamento químico do grupo hidroxila em outros compostos.
Os álcoois funcionam como substâncias anfóteras, isto é, comportam-se às vezes como ácido e às vezes como base, ambos muito fracos. Isso vai depender principalmente da natureza do outro reagente. A acidicidade dos álcoois se deve ao fato de existir um hidrogênio ligado a um átomo muito eletronegativo, o oxigênio. O caráter ácido dos álcoois segue a seguinte ordem de intensidade: álcool primário > álcool secundário >álcool terciário. Isso ocorre por causa do efeito indutivo +I do grupo alquilo. Quanto mais radicais existirem, maior será a densidade eletrônica no oxigênio, e mais fortemente ligado estará o hidrogênio.
As principais reações dos álcoois são:
- Desidratação
- Eliminação em dióis
- Eliminação em álcoois cíclicos
- Reação com HX diluído
- Reação com HI concentrado
- Reação com cloreto de tionila
- Reação com haletos de fósforo
- Reação com ácidos (Esterificação)
- Reação com aldeídos ou cetonas
- Reação com cloretos de ácidos
Aplicações dos álcoois
Os álcoois mais simples são muito usados, dentre outras coisas, como:
- Solventes na indústria e no laboratório
- Componentes de misturas “antifreeze” – para baixar o ponto de solidificação
- Matéria-prima de inúmeras reações para obtenção de outros compostos orgânicos
- Combustível
- Componente de bebidas (etanol)
Um diálcool (glicol) muito importante é o etileno-glicol (CH2OH – CH2OH), preparado pela oxidação do etileno por perácido. É muito usado como:
- Umectante
- “Anti-freeze” – para baixar o ponto de congelamento da água de radiadores em países frios
- Fluido em breques hidráulicos
- Matéria-prima de plásticos e fibras (poliésteres)
A glicerina (CH2OH – CHOH – CH2OH) é um triálcool de grande aplicação. Dentre os principais usos estão:
- Solventes
- Tintas
- Plastificantes
- Lubrificantes
- Agente adoçante
- Componente de cosméticos
Metanol ou álcool metílico
Líquido muito inflamável.
Ponto inflamável 4ºC (crisol fechado).
Líquido incolor, com cheiro, completamente miscível com a água.
Volátil. Ponto de ebulição 65ºC.
Os vapores são invisíveis e mais densos que o ar e formam com ele mesclas explosivas entre uns 6% e 36,5% em volume de vapor de metanol. Cuidado com os recipientes vazios que contenham resíduos.O aquecimento do recipiente origina um aumento da pressão.Perigo de estourar e explodir.
Os vapores são invisíveis e mais densos em relação ao ar .No contato com este firmam misturas explosivas.que variam de 6% até 36,5% em volume de vapor do metanol. Tomar conta dos recipientes vazios que contenham resíduos dentro.
Quando o recipiente esquentar produz incremento de pressão. Perigo de estalido e explosão!
Toxicidade:
O metanol é tóxico tanto em estado líquido ou em estado de vapor. Pode ingressar ao organismo pelo nariz, boca ou pele (especialmente através de cortes ou ferimentos) e é rapidamente absorvido pelas vias sanguíneas do corpo.
Ingestão: A ingestão direta produz a resposta mais rápida, sendo 50 a 100 ml usualmente uma dose mortal, porém 25 a 50 ml são frequentemente mortais se o paciente não é tratado imediatamente. A tolerância individual varia amplamente. Deve- se tomar todas as precauções para evitar que o metanol não seja ingerido por erro e deve ser estritamente proibido sorver com a boca.
Inalação: Altas concentrações de vapores de metanol podem produzir envenenamento agudo depois de breves exposições. Considera-se que 200 ppm de vapor de metanol em volume (0,25 mg/litro a 25ºC e 1 atm) é o limite máximo permitido na atmosfera para um trabalho de 8 horas diárias, 40 horas semanais.
Contato com a pele: O efeito imediato do metanol na pele é a perda da oleosidade e o ressecamento, típicos também de outros solventes. Contudo o metanol pode também ser absorvido pela pele e causar os efeitos tóxicos e letais descritos anteriormente.
Exposição aos olhos: Os efeitos imediatos do metanol são similares aos de outros solventes, sendo recomendado que se lave rapidamente. Através de contato direto, inalado ou ingerido, o metanol causa visão turva, uma extrema sensibilidade à luz (fotofobia) e inflamação (conjuntivite). Exposições severas podem destruir o nervo ótico, levando à cegueira e causar lesões oculares. Algumas vezes os sintomas oculares podem desaparecer inicialmente, porém retornam causando cegueira.
Etanol ou álcool etílico
Líquido incolor, com cheiro, completamente miscível com a água. Volátil. Ponto de ebulição 81ºC. Os vapores são invisíveis e mais densos que o ar e formam com ele mesclas explosivas. Cuidado com os recipientes vazios que contenham resíduos.O aquecimento do recipiente origina um aumento da pressão.¡Perigo de estourar e explodir! O líquido e seus vapores produzem irritação nos olhos, pele ou vias respiratórias. Os vapores em altas concentrações podem originar náuseas.
O etanol ou álcool etílico, apresenta duas funções principais: “commodity chemical” e indústria de bebidas alcoólicas.
Após a água, o álcool é o solvente mais comum, além de representar a matéria-prima de maior uso no laboratório e na indústria química. Na biossíntese do etanol é empregado linhagens selecionadas de Saccharomyces cerevisae, que realizam a fermentação alcoólica, a partir de um carboidrato fermentável. É muito importante que a cultura de levedura possua um crescimento vigoroso e uma elevada tolerância ao etanol, apresentando assim a fermentação um grande rendimento final. O etanol é inibidor a altas concentrações, e a tolerância das leveduras é um ponto crítico para uma produção elevada deste metabólito primário. A tolerância ao etanol varia consideravelmente de acordo com as linhagens de leveduras. De modo geral, o crescimento cessa quando a produção atinge 5% de etanol (v/v), e a taxa de produção é reduzida a zero, na concentração de 6 a 10% de etanol (v/v).
O etanol pode ser produzido a partir de qualquer carboidrato fermentável pela levedura: sacarose, sucos de frutas, milho, melaço, beterrabas, batatas, malte, cevada, aveia, centeio, arroz sorgo etc, (necessário hidrolisar os carboidratos complexos em açúcares simples fermentáveis, pelo uso de enzimas da cevada ou fúngicas, ou ainda pelo tratamento térmico do material acidificado).
Material celulósico, como madeira e resíduos da fabricação da pasta de papel podem ser utilizados. Por causa da grande quantidade de resíduos de material celulósico disponível, a fermentação direta desses materiais quando hidrolisados por enzimas celulolíticas pode ser de grande importância econômica.
Culturas mistas de Clostridium thermocellum e C. thermosaccharolyticum podem ser usadas. Hemiceluloses e celuloses são hidrolisadas em monossacarídeos (hexoses e pentoses) por essas bactérias e os monossacarídeos são fermentados diretamente a etanol.
O processo de produção de etanol:
A produção de etanol é iniciada aerobicamente para produzir o máximo de biomassa.
O etanol é produzido em três etapas principais:
- Preparação da solução nutriente;
- Fermentação;
- Destilação do etanol.
A química toxicológica:
Etanol (EtOH). A toxicidade pelo etanol mostra-se relacionada à dose, mas a tolerância varia amplamente entre os indivíduos. Níveis sanguíneos maiores do que 100 mg/dl definem, em termos legais, o estado de intoxicação e estão tipicamente associados com ataxia; com 200 mg/dl, os pacientes estão sonolentos e confusos. Com níveis acima de 400 mg/dl geralmente há depressão respiratória, sendo possível à morte.Estudos laboratoriais devem incluir nível de eletrólitos, glicose, osmolalidade sérica e nível de EtOH no sangue. O nível de EtOH no sangue pode ser rapidamente estimado pelo cálculo do intervalo de osmolalidade (osmolalidade medida menos a osmolalidade calculada). O nível de álcool no sangue em miligramas/decilitro dividido por 4,3 é igual ao intervalo de osmolalidade, na ausência de outras toxinas de baixo peso molecular.
Nível de álcool no sangue = 4,3 (osmolalidade medida – osmolalidade calculada)
Álcool isopropílico (AIP). O álcool para uso externo é o AIP de 70%. Ele é mais tóxico do que o EtOH em qualquer nível sanguíneo (50 mg/dl = intoxicação, 100-200 mg/dl = estupor e coma). Depressão respiratória e hipotensão ocorrem quando os níveis sanguíneos são altos. Náusea, vômitos e dor abdominal ocorrem frequentemente; também pode ocorrer hipoglicemia. A avaliação laboratorial comumente revela cetose sem acidose (o AIP é metabolizado até acetona). Acidose metabólica encontra-se geralmente relacionada com hipotensão associada. A concentração de AIP no sangue pode ser medida diretamente ou ser estimada da mesma maneira como o EtOH, substituindo-se o denominador 5,9 por 4,3.
Metanol (MeOH): É encontrado em líquido para limpar para-brisas e em anticongelantes. O esterno contém tanto EtOH quanto MeOH, e o EtOH presente pode retardar as manifestações de toxicidade pelo MeOH. A toxicidade pelo MeOH é devida à sua conversão por desidrogenase alcoólica a formaldeído e ácido fórmico. EtOH retarda esse metabolismo, competindo com essa enzima. O paciente pode ter sintomas iniciais de letargia e confusão, seguidos por uma aparente “ressaca”. Os sintomas tóxicos consistem de enxaqueca, sintomas visuais, náusea, vômitos, dor abdominal, taquipnéia e insuficiência respiratória. Coma e convulsões podem ocorrer em casos graves.O exame revela caracteristicamente um paciente com desconforto, que pode estar muito taquipnéico e com acuidade visual diminuída; hiperemia de disco óptico pode ser de difícil apreciação. Estudos laboratoriais devem incluir CBC, eletrólitos, BUN, creatinina, amilase, nível de EtOH, nível de MeOH, e GSAs, que irão revelar uma acidose metabólica com gap aniônico grave. A faixa de ingesta tóxica é de 15-400 ml. Em geral, o pH e o estado ácido-básico são melhores previsores da toxicidade do que o nível absoluto. O nível de MeOH em mg/dl pode ser estimado da mesma forma como o do EtOH, substituindo-se o denominador 2,6 por 4,3.
Danos causados ao organismo de quem consome muita bebida alcoólica
Para muitos brasileiros, festa é sinônimo de cerveja. Diversão, sinônimo de porre. Em alguns lugares criam-se festas de adoração à bebida alcoólica, tal como a oktoberfest em Blumenau. No supermercado, qualquer criança pode sair com litros de uma substância tóxica e entorpecente: etanol, a droga legal.
Na produção de bebidas, tal como whiskey e vodka, as impurezas é que dão o sabor diferencial.
Substratos de batatas, milho, trigo e outras plantas podem ser usados na produção do etanol por fermentação. Uma enzima, a diastase (ou maltase), converte o amido em açúcares e, então, a enzima se converte-os em álcool.
O etanol produzido por fermentação chega no máximo a 14% na solução: acima desta concentração, o etanol destrói a enzimae a fermentação para.
O etanol pode ser concentrado por destilação, mas ocorre a formação de um azeótropo (mistura de ponto de ebulição constante) a 96% de etanol em água.
Portanto, o etanol puro não pode ser obtido por destilação. A indústria utiliza agentes desidratantes ou prepara o etanol sinteticamente, a partir de acetaldeído, que é feito através do acetileno.
Quando uma bebida alcoólica é ingerida, o etanol é absorvido no intestino delgado e distribuído pelo corpo – sendo que mais etanol é encontrado no sangue e no cérebro do que nos músculos e tecidos adiposos. O etanol é uma substância tóxica, e o organismo inicia o processo de excreção desta substância tão logo ela é consumida. Cerca de 90% é processado no fígado – a enzima álcool desidrogenase converte etanol em acetaldeído, que também é uma substância tóxica (responsável pela enxaqueca!). O aldeído é convertido a acetato, pela enzima aldeído desidroxigenase.