A função mais simples da química orgânica é formada pelos hidrocarbonetos, compostos formados, como o próprio nome sugere, somente por carbono (C) e hidrogênio (H).
Os hidrocarbonetos são encontrados na natureza na forma líquida, como o petróleo, ou gasosa, como o gás natural. São importantes fontes de combustível, mas também muito conhecidos pelo seu potencial poluidor.
A biodegradação desses compostos está sendo estudada como mecanismo de limpeza biológica, sem interferência química no ambiente. São micro-organismos capazes de degradar as moléculas que compõem o contaminante, gerando compostos menos tóxicos.
Nomenclatura geral
Segundo a IUPAC, os compostos orgânicos não ramificados recebem nomenclatura de acordo com três parâmetros:
Prefixo + infixo + sufixo
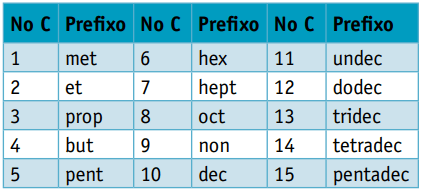
Um prefixo, considerando o número de carbonos que os compõem:
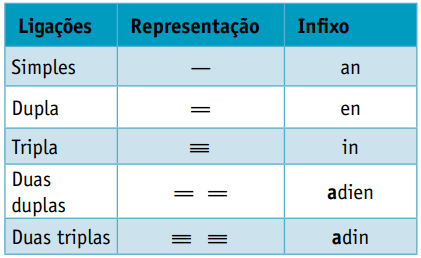
Um infixo, que leva em conta os tipos de ligação entre carbonos:
Um sufixo, que depende do tipo de função à qual pertence o composto orgânico. No caso de hidrocarbonetos, o sufixo é o.
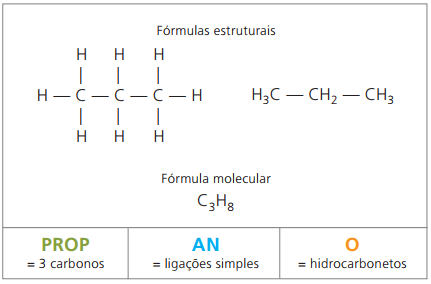
Exemplo 1:
CH3 – CH2 – CH2 – CH2 – CH3
Prefixo: 5 carbonos = pent
Infixo: ligação simples entre carbonos = an
Sufixo: hidrocarboneto (só H e C) = o
Portanto: pentano (C5H12)
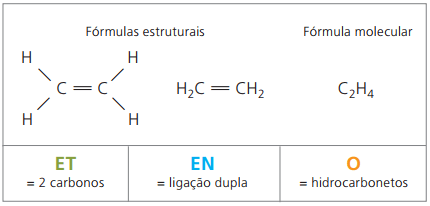
Exemplo 2:
CH2 = CH – CH3
Prefixo: 3 carbonos = prop
Infixo: somente 1 ligação dupla entre carbonos = en
Sufixo: hidrocarboneto (só H e C) = o
Portanto: propeno (C3H6)
Classificação
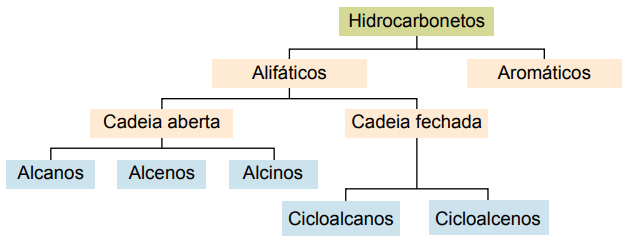
Os hidrocarbonetos podem ser classificados de acordo com suas cadeias carbônicas:
- Saturados: com ligações covalentes simples.
- Insaturados: com ligações covalentes duplas ou triplas.
- Aromáticos: com ao menos um anel benzênico.
- Alifáticos: sem anel benzênico.
Os principais tipos são: alcanos, alcenos, alcinos, alcadienos, cicloalcanos, cicloalcenos e aromáticos.
Alcanos ou parafinas
Compostos orgânicos pertencentes à função dos hidrocarbonetos alifáticos saturados, isto é, aqueles de cadeia aberta que contêm apenas simples ligações (–) entre átomos de carbono. Deles forma-se o petróleo, bem como seus derivados: gasolina, gás de cozinha, óleo diesel. Nas indústrias petroquímicas, servem como matéria-prima na fabricação de diversos materiais, como plásticos, fibras têxteis, tintas e borrachas sintéticas.
Termo designado aos alcanos, parafina, do latim parum = pequena + affinis = afinidade, refere-se a compostos de baixa reatividade química.
São exemplos de alcanos: metano e propano
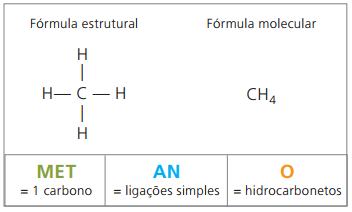
Metano é substância gasosa na temperatura ambiente, inodora e incolor. Na natureza, produz-se pela decomposição da matéria viva, tanto de origem animal quanto vegetal, por isso se encontra em grande quantidade nos pântanos. Na formação das jazidas de carvão, libera-se quando misturado ao ar, originando uma combinação explosiva conhecida como gás grisu.
O propano forma, com o butano, alcano com quatro carbonos, mistura gasosa conhecida como gás de cozinha (gás liquefeito do petróleo, GLP), utilizada como combustível residencial.
Formulação
Fórmulas moleculares dos alcanos possuem número de hidrogênios igual ao dobro do número de carbonos mais dois. Daí, conclui-se que têm composição geral do tipo CnH2n + 2, em que n é número de carbonos. Para que eles possuam seis carbonos, como é o caso do hexano, o número de hidrogênios iguala-se a 14, e a fórmula molecular é C6H14.
Fórmula geral dos alcanos: CnH2n+2-
Alcenos ou alquenos ou olfinas
Alcenos, também chamados alquenos ou olefinas, são compostos orgânicos da função hidrocarboneto. Possuem cadeia alifática insaturada por dupla ligação (=) entre carbonos.
Olefina provém do latim oleum = óleo + affinis = afinidade. Portanto, compostos dos alquenos possuem alta reatividade com substâncias oleosas.
Etileno e propileno são dois principais alcenos da indústria petroquímica. Apresentam nomenclatura usual em relação aos seus nomes, segundo regras da IUPAC.
Obtém-se o etileno, industrialmente, por meio da quebra (cracking) de longas cadeias de alcanos. Com ele, fabrica-se plástico polietileno, polímero usado como sacolas (normalmente de supermercados), sacos de lixo, corpos de canetas esferográficas. A banana e o tomate, liberam o gás etileno naturalmente e assim amadurecem.
Emprega-se o propileno, também chamado propeno, na fabricação do polímero polipropileno, usado em peças moldadas, como para-choques de veículos.
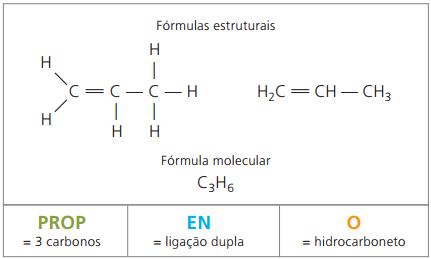
A partir de quatro carbonos na estrutura, depara-se com um problema de nomenclatura dos alcenos, em razão de a dupla ligação estar em diferentes posições ao longo da cadeia, originando compostos diferentes. Para resolver essa situação, a IUPAC recomenda o uso indicando a posição da dupla ligação de números na cadeia principal a partir da extremidade mais próxima da insaturação. Assim, dá-se nome ao alceno com base no carbono de menor número entre os dois átomos que constituem a ligação dupla.
Antigamente, representava-se a numeração referente à dupla-ligação com algarismo arábico antecedendo o nome do composto e separado por hífen. Atualmente (de acordo com a IUPAC), ela é representada usando-se hifens, dispondo o número da instauração entre o prefixo e o infixo. Assim:
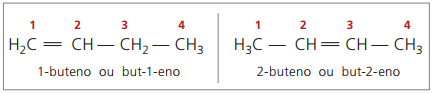
No caso do composto 2-buteno, como a dupla-ligação é equidistante das extremidades, começa-se a numeração da cadeia pelo lado direito. Entretanto, no caso do 1-buteno, a numeração obrigatoriamente se inicia na parte mais próxima da insaturação, não havendo, por isso, composto but-3-eno, pois este, automaticamente, chama-se but-1-eno.
Formulação
Alcenos, bem como alcanos, têm fórmula geral deduzida com base na observação dos exemplos mencionados. Em geral, possuem número de hidrogênio igual ao dobro do número de carbonos. Assim, a fórmula geral é CnH2n.
Alcinos ou alquinos
Alcinos ou alquinos são hidrocarbonetos alifáticos insaturados por uma tripla ligação (≡), ou seja, compostos de cadeia aberta com presença de tripla ligação entre carbonos. O etino ou acetileno é um exemplo de alcino.
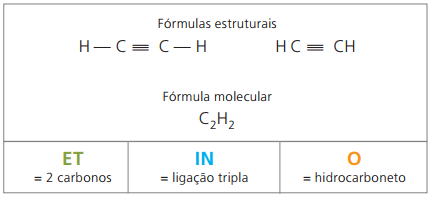
Etino é um gás pouco solúvel em água, conhecido como acetileno e obtido na reação de carbureto (CaC2) com a água, segundo a equação química:
CaC2(s) + 2 H2O(ℓ) Ca(OH)2(aq) + HC = CH(g)
Acetileno propicia queima com intensa liberação de calor e luz, por isso exploradores de cavernas usam-no em lanterna de carbureto e maçaricos de oxiacetileno.
Regras de nomenclatura, em relação à numeração da tripla ligação, são as mesmas usadas na nomenclatura dos alcenos.
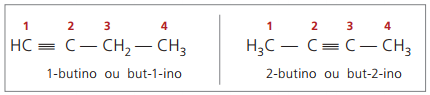
Alcinos verdadeiros possuem, pelo menos, um átomo de hidrogênio ligado diretamente a um carbono da insaturação (tripla ligação), e alcinos falsos não apresentam átomos de hidrogênio ligados a um carbono da tripla ligação.
Observando estruturas anteriores, but-1-ino e but-2-ino, percebe-se que a quantidade de hidrogênios na substância é sempre igual ao dobro do número de carbonos menos dois, portanto a fórmula geral dos alcinos é CnH2n – 2.
Alcadienos ou dienos
São hidrocarbonetos alifáticos insaturados por duas ligações duplas (= =), responsáveis pela obtenção de alguns polímeros que originam a borracha natural.
Com relação à nomenclatura, segundo parâmetros da IUPAC, continuam válidas todas as observações feitas anteriormente para compostos insaturados. Contudo, a partir de quatro carbonos no composto, faz-se necessária a indicação das insaturações por dois algarismos que precedem o nome da substância.
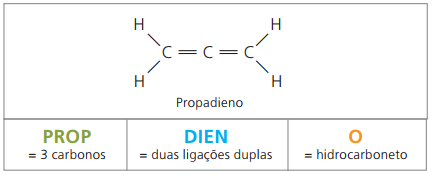
Com quatro carbonos na estrutura dos dienos, necessita-se da numeração das duplas ligações. Considere a substância a seguir.
CH3 – CH = CH – CH2 – CH = CH2
Numera-se a cadeia principal pela extremidade mais próxima de uma das insaturações.
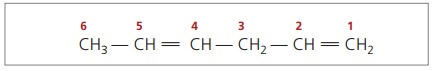
Algarismos representados são as menores numerações entre aqueles em que as duplas ligações estão contidas, portanto:

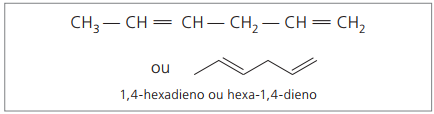
Analisando a cadeia anterior (hexa-1,4-dieno), percebe-se que a quantidade de átomos de hidrogênio é o dobro do número de carbono menos dois.
A fórmula geral dos alcadienos é a mesma dos alcinos. Isso significa obtenção de substâncias diferentes por meio de fórmula molecular semelhante — CnH2n – 2.
Ciclanos ou cicloalcanos
Hidrocarbonetos alicíclicos saturados, ou seja, compostos de cadeia carbônica fechada contendo apenas ligações simples entre átomos de carbono.
A nomenclatura do ciclano junto à IUPAC é a mesma dos alcanos, diferindo-se apenas pela adição da palavra ciclo antecedendo o nome do composto.
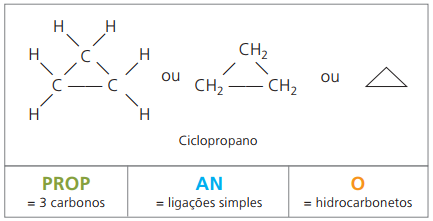
Usa-se ciclopropano, composto mais simples dos ciclanos, como anestésico.
A fórmula geral dos ciclanos é a mesma dos alcenos, — CnH2n.
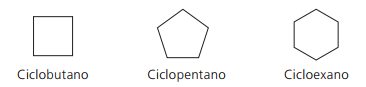
Exemplos de ciclanos:
Ciclenos ou Cicloalcenos
Hidrocarbonetos alicíclicos insaturados por uma dupla ligação entre dois átomos de carbono. Sua nomenclatura assemelha-se à dos alcenos adicionada à palavra ciclo, que antecede o nome do composto. A fórmula geral é igual à dos alcinos e dos alcadienos — CnH2n – 2.
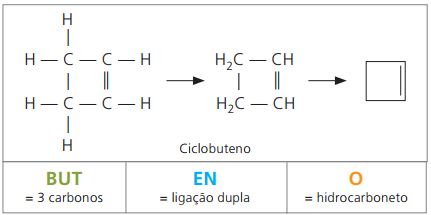
Exemplos de ciclenos:

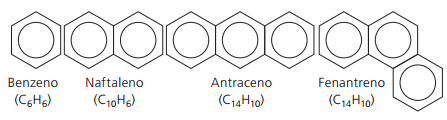
Hidrocarbonetos aromáticos
Hidrocarbonetos que apresentam pelo menos um anel benzênico são chamados aromáticos, pois os primeiros compostos obtidos tinham aroma agradável, embora existam estruturas que não oferecem odor.
Compostos aromáticos possuem nomenclatura própria. Não seguem, por isso, nenhua regra específica em comparação com os demais hidrocarbonetos. Além disso, não apresentam fórmula geral para todos os compostos.
Principais aromáticos não ramificados:
 Por: Wilson Teixeira Moutinho
Por: Wilson Teixeira Moutinho
Assuntos relacionados:
- Alcanos, Alcenos, Alcinos e Alcadienos
- Classificação das Cadeias Carbônicas
- Funções Orgânicas
- Séries Homólogas