CONCEITO DE EQUILÍBRIO QUÍMICO
A rigor, todas as reações químicas são reversíveis, isto é, ocorrem simultaneamente no sentido reagentes → produtos e no sentido produtos → reagentes. Em muitos casos, porém, a reação no sentido produtos → reagentes ocorre em proporção tão pequena que, do ponto de vista prático, essa reação é considerada irreversível.
Consideremos uma reação representada pela equação geral:
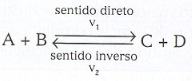
Sejam V1 e V2 as velocidades das reações direta e inversa, respectivamente. Supondo que essas reações sejam elementares, temos:
V1 = K1 [A] [B] e V2 = K2 [C] [D]
No início da reação, isto é, no instante em que misturamos a mols de A com b mols de B, V1 assume o seu valor máximo, porque [A] e [B] têm seus valores máximos. Com o decorrer do tempo, [A] e [B] vão diminuindo, pois A e B vão sendo consumidos na reação direta e, consequentemente, V1 vai diminuindo.
À medida que C e D vão-se formando na reação, suas concentrações vão aumentando e, consequentemente, V2 aumenta com o decorrer do tempo.
Como V1 diminui e V2 aumenta, depois de algum tempo teremos V1 = V2. A partir desse instante, [A], [B], [C] e [D] permanecem constantes, porque, num mesmo intervalo de tempo, o número de mols de cada substância consumidos numa reação é igual ao número de mols formados na reação de sentido oposto.
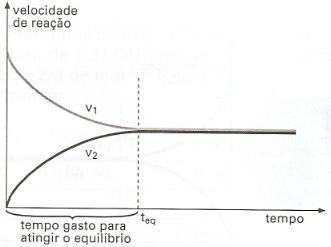
No instante em que V1 = V2, dizemos que o sistema atingiu o equilíbrio. A partir desse instante, o sistema constitui um equilíbrio químico.
Equilíbrio químico é uma reação reversível, na qual a velocidade da reação direta é igual à velocidade da reação inversa. Consequentemente, as concentrações de todas as substâncias participantes permanecem constantes.

CONSTANTE DE EQUILÍBRIO EM SISTEMAS HOMOGÊNEOS
Consideremos o equilíbrio representado pela equação geral:
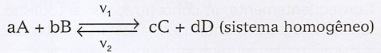
Supondo que as reações nos dois sentidos sejam elementares, temos:
v1 = k1 [A]a [B]b v2 = k2 [C]c [D]d
Equilíbrio → v1 = v2 → k1 [A]a [B]b = k2 [C]c [D]d
Kc = constante de equilíbrio
A expressão da constante de equilíbrio (Kc) é a lei da ação das massas, ou lei de Guldberg e Waage do equilíbrio. Foi estabelecida em 1864 por esses cientistas noruegueses.
Na dedução da expressão do Kc que acabamos de fazer, admitimos que as reações nos dois sentidos fossem elementares. Na maioria dos casos, porém, essas reações ocorrem em várias etapas. Esse fato pode afetar a interpretação cinética da dedução da expressão do Kc, mas não afeta a expressão final do Kc, deduzido pela termodinâmica, através da energia livre da reação.
Por convenção, as concentrações dos produtos figuram no numerador da expressão da constante de equilíbrio, e as concentrações dos reagentes figuram no denominador.
A constante de equilíbrio recebe nomes particulares, de acordo com o nome da reação envolvida. Por exemplo, numa reação de decomposição ou dissociação, Kc é chamado de constante de dissociação.
Existem equilíbrios nos quais a reação no sentido direto ocorre em grande extensão. Consequentemente, no sentido inverso, ocorre em pequena extensão. Nesses equilíbrios, as concentrações dos produtos são grandes, se comparadas às dos reagentes, e o valor do Kc é elevado.
Existem equilíbrios em que acontece o oposto, isto é, a reação no sentido direto ocorre em pequena extensão, enquanto a reação no sentido inverso ocorre em grande extensão. Nesses equilíbrios, as concentrações dos produtos são pequenas, se comparadas às dos reagentes, e, consequentemente, o valor do Kc é pequeno.
Conclusão:
Quanto maior o valor da constante de equilíbrio (Kc), mais completa é a reação no sentido direto, e vice-versa.
O valor do Kc varia muito de um equilíbrio para outro. Para um mesmo equilíbrio, o valor de Kc varia com a temperatura, mas não varia com a concentração das substâncias participantes, nem com a pressão.
Vejamos a expressão da lei da ação das massas, de Guldberg e Waage, aplicada aos equilíbrios seguintes, ou seja, a expressão das respectivas constantes de equilíbrio (Kc).

CONSTANTE DE EQUILÍBRIO EM SISTEMAS HETEROGÊNEOS
Equilíbrios heterogêneos são aqueles nos quais os reagentes e os produtos formam um sistema heterogêneo. Veja os quatro exemplos seguintes:
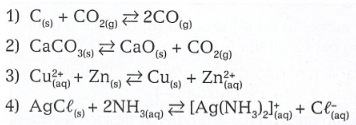
Como as concentrações dos sólidos são constantes, elas não aparecem na expressão da constante de equilíbrio. As expressões do K e do K (se houver) dos equilíbrios dados serão:

Por: Renan Bardine