O NOX e o tipo de ligação
Chamamos de número de oxidação ou nox a carga assumida por um átomo quando a ligação que o une a um outro é quebrada. Existem três casos a serem analisados com relação ao nox de um elemento: composto iônico, covalente e substância simples.
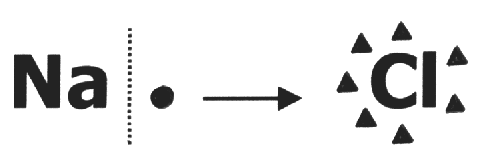
Num composto iônico, ou nox é a própria carga do íon, pois quando a ligação se rompe, já ocorreu a transferência do elétron do átomo menos para o mais eletronegativo.
Na formação do NaCl, o Na passa de 11 para 10 elétrons e o Cl passa de 17 para 18 elétrons. O Na fica com carência de 1 elétron e assume a carga 1+, o Cl fica com excesso de um elétrons e assume a carga 1-. Então, os nox do Na e do Cl, neste composto, serão respectivamente 1+ e 1-.
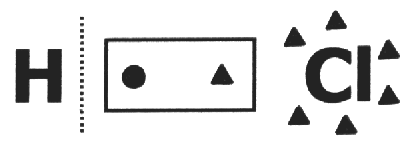
Num composto covalente assume-se que a mesma se quebra e que o par de elétrons fica com o átomo mais eletronegativo. Na molécula de HCl, o átomo mais eletronegativo é o Cl e o menos é o H. O Cl adiciona um elétron à sua eletrosfera, enquanto o H perde um. Então, os nox do Cl e do H serão, respectivamente, 1- e 1+.
Em uma substância simples, os nox de todos os átomos componentes é igual a zero, pois não é possível a existência de diferenças de eletronegatividade. Exemplos: S8, H2, O2, P4, Cgraf, Cdiam.
Regras para a determinação do NOX
Metais alcalinos 1+
Metais alcalino-terrosos 2+
Oxigênio (menos nos peróxidos, em que é 1-) 2 –
Hidrogênio (menos nos hidretos, em que é 1-) 1+
Alumínio (Al) 3+
Zinco (Zn) 2+
Prata (Ag) 1+
Substâncias simples 0
A soma dos números de oxidação num composto é igual a zero.
A soma dos números de oxidação num íon composto é igual a carga do íon.
Exemplos
Compostos binários
O nox de um dos elementos deve ser conhecido para que o outro possa ser calculado.
Na Cl
O Na por ser metal alcalino, tem nox igual a 1+. Como a soma dos nox num composto é igual a zero, o Cl tem nox igual a 1-.
Compostos ternários
O nox de dois dos elementos deve ser conhecido para que o terceiro possa ser calculado.
H2SO4
O H tem nox igual a 1+. O O tem nox igual a 2-. O nox do S, por ser variável, não consta de tabelas e deve ser calculado. 2 átomos de H somam uma carga total de 2+. 4 átomos de O somam uma carga total de 8-. Para que a carga do composto como um todo seja igual a zero, a carga do S tem de ser igual a 6+.
Íons
A somatória das cargas deve ser igual a carga total do íon.
(NH4)+
O nox do H é igual a 1+. Como os H são em número de 4, a carga total deles é igual a 4+. Para que a carga total seja igual a 1+, o nox do N tem de ser 3-.
(SO4)2-
O nox do O é igual a 2-. Como são 4 átomos de O, sua carga total é igual a 8-. Para que a carga total do íon seja igual a 2-, o nox do S tem que ser igual a 6+.