São poucas as substâncias encontradas puras na natureza. Entre elas, há o ouro e o cobre. Para as substâncias serem obtidas de forma pura, é necessária a utilização de métodos de separação de misturas.
Para separar uma mistura, é preciso, em primeiro lugar, observar se ela é heterogênea ou homogênea e, em seguida, escolher o processo mais adequado para fazer a separação.
Muitas vezes, dependendo da complexidade da mistura, exige-se um conhecimento prévio de algumas propriedades das substâncias presentes, como, temperatura de fusão, temperatura de ebulição, se a mistura se dissolve na água ou não etc.
Veja a seguir os processos de separação mais comuns.
Métodos de separação de misturas heterogêneas
Nos processos de separação de misturas heterogêneas, utilizamos métodos mecânicos (que, muitas vezes, não envolvem mudança de estado físico dos componentes), uma vez que o objetivo é a separação de fases. Portanto, trata-se de procedimentos mais simples e baratos.
Catação
A catação talvez seja o tipo mais simples de separação de misturas, realizado manualmente. A catação é uma cena muito comum nas casas brasileiras quando se separam impurezas que estão misturadas aos grãos, por exemplo. Esse é um processo de separação de misturas heterogêneas cujos componentes são sólidos.

Peneiração
A peneiração tem como objetivo separar componentes de misturas heterogêneas que apresentam partículas sólidas de diferentes tamanhos. Essa técnica consiste em usar uma peneira, cujos furos podem ter diferentes tamanhos, para separar os grãos maiores dos menores.

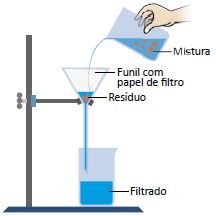
Filtração
A filtração consiste, basicamente, na utilização de um filtro para separar os elementos sólidos dos líquidos. Um filtro é feito de materiais porosos que retêm os componentes da mistura, de acordo com o tamanho dos poros. Exemplos: coar o café, filtrar a água, aspirar o pó com aspirador.
Flotação (flutuação)
É usada, por exemplo, para separar uma mistura de areia e pó de madeira (serragem).
Para promover essa separação basta acrescentarmos água à essa mistura; assim, a água ocupará a fase intermediária, a serragem flutuará e a areia sedimentará. Retiramos, a seguir, a serragem com uma espátula e realizamos uma filtração para separar a água da areia.
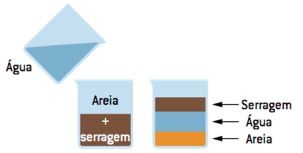
É um método de separação muito utilizado no tratamento de águas residuais e nas indústrias, no processamento de minerais.
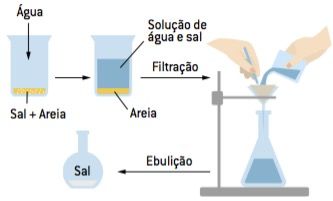
Dissolução fracionada
Separação de dois ou mais componentes sólidos, recorrendo a um solvente que dissolva apenas um dos componentes.
Adicionar água em uma mistura de areia e sal. A água vai dissolver o sal, mas não a areia, que ficará no fundo do recipiente. É preciso utilizar ainda outras técnicas para finalizar a separação. Por exemplo: uma filtração reterá a areia no papel-filtro e uma evaporação recuperará o sal dissolvido no filtrado.
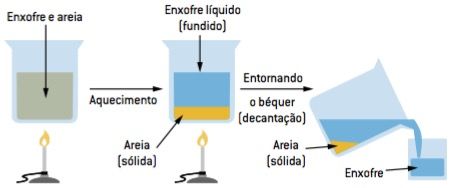
Fusão fracionada
Consiste em aquecer a mistura em um recipiente apropriado (cadinho). Conforme vai-se atingindo a temperatura de fusão de cada um dos componentes, estes vão sendo retirados do sistema e, com o resfriamento, solidificam-se novamente. Exemplo: separação de enxofre e areia. Observe o esquema:
Levigação
Usada quando um sólido é mais denso que o outro, separando-os com a corrente de água. Para separar areia e ouro: como a areia é menos densa, ela é arrastada pela água; o ouro, por ser mais denso, permanece no fundo.

Decantação
É um processo mecânico utilizado para separar os componentes de misturas heterogêneas formadas por sólido e líquido, líquido e líquido ou sólido e gás. Esse processo só é possível quando os componentes da mistura apresentam densidades diferentes. Assim, o componente de maior densidade sedimenta e o de menor densidade sobrenada. Exemplo: água e barro.

Centrifugação
Na centrifugação, utiliza-se uma máquina chamada de centrífuga, que gira a mistura em altas rotações. As substâncias mais densas acumulam-se no fundo do recipiente, e as substâncias menos densas permanecem na superfície. Essa técnica é muito utilizada em laboratórios de análises clínicas para fazer a separação dos componentes do sangue, que é uma mistura formada pelo plasma (parte líquida) e pelas células (parte sólida).

Ventilação
A ventilação é um processo de separação utilizado em misturas heterogêneas nas quais existem sólidos de diversas densidades. Passa-se uma corrente de ar pela mistura, para que os sólidos de menor densidade sejam carreados, permanecendo os sólidos mais densos. Esse tipo de separação é bastante utilizado em propriedades agrícolas para separar grãos, como arroz, feijão, milho e café, de suas folhas e galhos após a colheita.

por exemplo.
Separação magnética
A separação magnética baseia-se nas propriedades magnéticas dos materiais, ou seja, aqueles que podem ser atraídos por ímãs, como ferro e outros metais. Caso haja uma mistura heterogênea na qual um dos componentes seja um sólido com propriedades magnéticas, pode-se utilizar um ímã para atraí-lo e separá-lo do restante da mistura. Exemplo: mistura de limalha de ferro e enxofre.
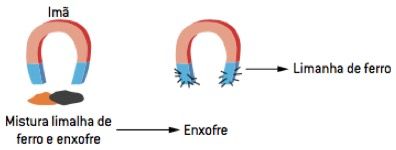
Separação de misturas homogêneas
Já no caso de misturas homogêneas, temos que recorrer a processos físicos que envolvem mudança de estado físico dos componentes, tendo em vista que o objetivo é a separação dos componentes. Também aqui, a aparelhagem envolvida é um pouco mais complexa.
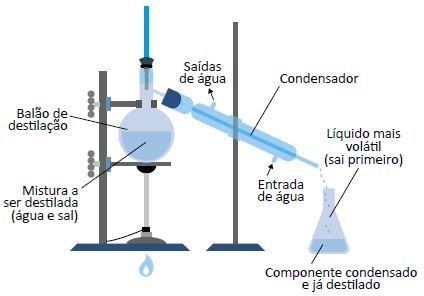
Destilação simples
Separação dos componentes de uma mistura homogênea formados por um sólido dissolvido em um líquido. Por exemplo, água e sal dissolvido.
Quando a mistura é aquecida, o líquido entra em ebulição e seus vapores passam por um aparelho denominado condensador. Em contato com o ambiente de menor temperatura no condensador, os vapores retornam à fase líquida e são recolhidos em um frasco. O sal ficará retido no balão de destilação após a água vaporizar.
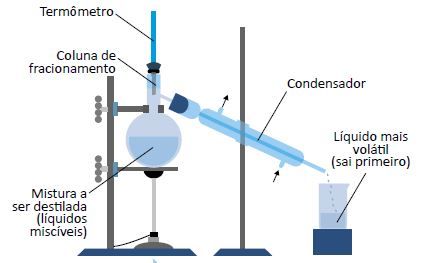
Destilação fracionada
É um processo físico utilizado para desdobrar misturas homogêneas constituídas por dois ou mais líquidos com diferentes temperaturas de ebulição.
A mistura a ser destilada é aquecida. O constituinte mais volátil — com menor ponto de ebulição — transforma-se em vapor; ao atravessar o condensador, resfria e muda novamente para o estado líquido, sendo recolhido (destilado).
Uma das aplicações mais comuns da destilação fracionada é o fracionamento do petróleo, utilizado na indústria petroquímica.
Extração
Processo seletivo em que adicionamos à mistura um solvente capaz de interagir com apenas um dos seus componentes. Com isso, forma-se uma mistura heterogênea, que deve ser desdobrada utilizando-se o método mais adequado.
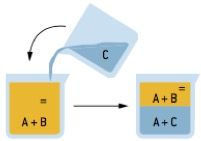
A extração tem grande aplicação industrial, sendo utilizada para retirar de plantas essências usadas em cosméticos, perfumes, entre outros.
Cristalização (evaporação)
O processo de cristalização é muito utilizado em salinas, também chamadas “minas de sal”. A técnica consiste em dissolver todos os componentes de uma mistura de sólidos em determinado solvente, que, em seguida, é separado por evaporação. Durante esse processo, cada componente sólido da mistura começa a se cristalizar separadamente, permitindo sua coleta e seu armazenamento. Exemplo: obtenção do cloreto de sódio (sal) da água do mar.
Veja também:
- Misturas Homogêneas e Heterogêneas
- Soluções e Dispersões
- Substâncias Simples e Compostas
- Fenômenos Químicos e Físicos
- Destilação