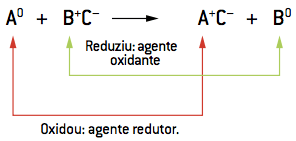
O deslocamento ou a simples troca, em química, consiste na reação de uma substância simples (A) com uma sustância composta (BC), originando outra substância composta (AC) e uma substância simples (B), de acordo com a reação.
A0 + B+ C– → A+ C– + B0
A equação produz uma única modificação – o elemento A, antes estável, reage com BC. Na reação, A assume o lugar de B no composto, que por sua vez ocupa o lugar de A, passando a ser um novo elemento estável na equação.
Sempre que isso ocorre em química, afirmamos que o elemento A deslocou o elemento B. A reação então passa a ser chamada de deslocamento ou simples troca. Na prática, tanto a substância simples quanto a substância composta, no início da reação, são substâncias estáveis. A reação ocorre, no entanto, pelo fato do agente A apresentar uma reatividade maior que o agente B.
Como a reatividade é a métrica que determina a possibilidade reação na simples troca, podemos analisar a propensão de um elemento em “deslocar” outro avaliando sua posição e reatividade na tabela periódica.
O comportamento de um metal em uma reação de simples troca é diferente do comportamento de um não metal. Ametais são mais eletronegativos, e geralmente recebem elétrons, sofrendo redução. Os metais, por outro lado, são eletropositivos e tendem a perder elétrons, sofrendo oxidação na simples troca. Assim sendo, existem dois tipos de reação de deslocamento: a reação de deslocamento de um cátion (metal) e a reação de deslocamento de um ânion (não metal).
Tipos de reações
1. Reação de deslocamento de um cátion (metal)
Considere a seguinte reação de deslocamento:
A0 + B+ C– → A+ C– + B0
Como vimos anteriormente, se o elemento químico A for um metal mais reativo que B, essa reação ocorrerá. De acordo com a reatividade dos metais, mostrada na representação da Tabela Periódica, é possível montar, simplificadamente, uma fila de reatividade dos metais.

Exemplos
- Fe(s) + CuSO4(aq) → FeSO4(aq) + Cu(s)
Essa reação ocorre, pois o ferro (Fe) possui maior reatividade que o cobre (Cu). - Fe(s) + Mg(NO3)2(aq) → Não ocorre.
O deslocamento não ocorre, pois o ferro possui menor reatividade em comparação ao magnésio (Mg). O deslocamento é impossível e a reação simplesmente não acontece.
2. Reação de deslocamento de um ânion (não metal)
Agora considere outra reação.
X0 + Y+ Z– → Y+ X– + Z0
Essa reação de deslocamento envolve não-metais. Sabemos disso porque o elemento substituído foi o ânion da substância composta. Além disso, o não-metal X é certamente mais reativo que o não-metal Z, assim ocorreu o deslocamento. Como no caso dos metais, podemos organizar os não-metais conforme sua reatividade:

A fila de reatividade dos não metais é parecida com a fila de eletronegatividade. Observa-se que o nitrogênio não entra nessa fila, pois, na molécula de N2, a ligação tripla existente entre os átomos de nitrogênio é muito difícil de ser rompida; é uma molécula muito pouco reativa.
Exemplos
- F2 + 2 NaCl → 2 NaF + Cl2
O flúor em forma estável (F2) desloca o cloro (Cl) no NaCl, por ser um ametal mais reativo. - Br2 + NaCl → Não ocorre.
O bromo, por outro lado, é menos reativo que o cloro. A reação não ocorre.
Por: Carlos Artur Matos