Se observarmos uma vela queimando, veremos que essa reação libera energia sob a forma de luz e calor. Mas qual é a origem dessa energia?
Toda substância possui certa quantidade de energia acumulada em seu interior, proveniente das ligações químicas entre seus átomos, dos movimentos de rotação, vibração e translação de suas partículas, das forças de atração e repulsão dos núcleos e dos elétrons de seus átomos, entre outros fatores. Esse conteúdo energético interno de cada substância recebe o nome de entalpia (ou conteúdo de calor).
Até hoje, não se conhece nenhum meio de calcular a entalpia (H) de uma substância. De forma prática, o que se pode determinar é a variação de entalpia (∆H), que é a medida da quantidade de calor absorvida ou liberada por um sistema, sob pressão constate. A variação de entalpia é obtida através de aparelhos denominados calorímetros.
Genericamente, podemos calcular a variação de entalpia através da expressão:
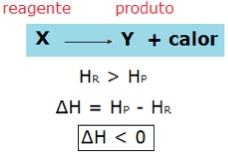
Em reações exotérmicas, a entalpia dos reagentes é maior que a entalpia dos produtos, por isso, há liberação de calor. Podemos representar genericamente:
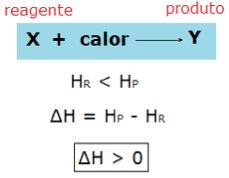
Já nas reações endotérmicas, a entalpia dos reagentes é menor que a entalpia dos produtos, por isso há absorção de calor. Genericamente, representamos:
Entalpia padrão
A variação de entalpia de uma reação química varia de acordo com a pressão, a temperatura, o estado físico, a quantidade de mols e a forma alotrópica de cada substância participante. Em virtude disso foi criada a entalpia padrão, utilizada como uma referência para comparações de entalpias.
Por convenção, foi determinado que toda substância simples, na sua forma mais estável, tem entalpia igual a 0. Logo, a entalpia padrão de uma substância é representada por H0.
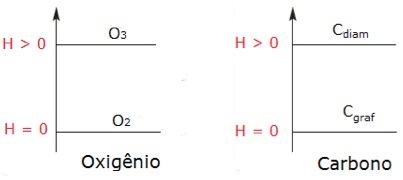
Assim, substâncias simples, como o gás oxigênio (O2), hidrogênio (H2), ferro sólido (Fe), grafite (forma mais estável do elemento carbono), nitrogênio (N2), no estado padrão (temperatura de 25 °C e pressão de 1 atm) têm entalpia igual a zero.
Observe nos gráficos a diferença de entalpia das formas alotrópicas do oxigênio e do carbono:
Entalpia de formação
A entalpia de formação é o calor absorvido ou liberado na formação (síntese) de 1 mol de uma substância a partir de substâncias simples correspondentes, em seu estado padrão.
Além de entalpia de formação, a variação de entalpia em reações desse tipo também pode ser chamada de calor de formação, entalpia padrão de formação, ∆H de formação ou, ainda, calor molar de formação (porque forma 1 mol da substância).
Vamos considerar o exemplo da formação da água, a 25 °C e 1 atm, em que todas as substâncias se encontram no estado padrão:
H2 (g) + ![]() O2 (g) → H2O (l) ∆H = -286,6 kJ/mol
O2 (g) → H2O (l) ∆H = -286,6 kJ/mol
Pela equação termoquímica podemos concluir que a entalpia de formação de 1 mol de água (H2O) a partir da reação de O2 e H2 (as formas mais estáveis do oxigênio e do hidrogênio, respectivamente), é de -286,6 kJ/mol. Note que se trata de uma entalpia de combustão porque os reagentes se encontram no estado padrão e a reação formou apenas 1 mol de água.
Podemos observar, também, que se trata de uma reação exotérmica, pois temos ∆H < 0.
Entalpia de combustão
A entalpia (ou calor) de combustão de uma substância é a quantidade de calor liberada na combustão completa de 1 mol de uma substância, considerando que todas as substâncias envolvidas se encontram no estado padrão.
Vejamos o exemplo da combustão completa do metano (CH4), a 25 °C e 1 atm:
CH4 (g) + 2 O2 → CO2 (g) + 2 H2O ∆H = -889,5 kJ/mol
Essa equação representa a combustão de 1 mol de CH4, que produz 1 mol de gás carbônico (CO2) e 1 mol de água (H2O), com variação de entalpia de -889,5 kJ/mol. Todas as reações de combustão são exotérmicas, por isso, temos ∆H negativo.
Entalpia de neutralização
A entalpia de neutralização é o calor liberado na formação de 1 mol de H2O a partir da reação de 1 mol de íons H+ (aq) e 1 mol de OH– (aq), sob condições padrão.
Considere, por exemplo, a seguinte reação:
H+ (aq) + OH– (aq) → H2O (l) ∆H = -57,7 kJ/mol
Sempre haverá liberação de calor nas reações de neutralização (∆H < 0), no entanto, o valor de ∆H de neutralização será constante somente se for igual a -57,7 kJ/mol de H2O em reações entre ácidos e bases fortes.
Entalpia de ligação
Entalpia de ligação é a quantidade de calor envolvida na quebra de 1 mol de ligações químicas entre os átomos das substâncias, sob temperatura de 25 °C e pressão de 1 atm.
H2 + Cl2 → HCl ∆H = – 184 kJ/mol
O rompimento de ligações químicas sempre é um processo endotérmico, enquanto a formação de uma ligação química é sempre um processo exotérmico. Quanto maior for a entalpia de ligação, mais forte será a ligação química, e, portanto, mais difícil será a quebra.
Referências
FELTRE, Ricardo. Química volume 2. São Paulo: Moderna, 2005.
USBERCO, João, SALVADOR, Edgard. Química volume único. São Paulo: Saraiva, 2002.
Por: Mayara Lopes Cardoso
Veja também:
- Entropia
- Termoquímica
- Cinética Química
- Energia Livre de Gibbs
- Reações Endotérmicas e Exotérmicas
- Reações Espontâneas e Não Espontâneas