Normalmente, define-se a entropia como a medida de desordem de um sistema termodinâmico, bem como da espontaneidade dos processos químicos e físicos. A palavra entropia tem origem grega e significa “transformação”.
Vamos pensar, por exemplo, num papel queimado. A queima desse papel produz gás carbônico, água, cinzas, além de liberar energia sob a forma de calor. Porém, se reunirmos o gás carbônico, a água e as cinzas e aquecermos esse sistema, não conseguiremos reconstruir o papel novamente. Podemos dizer, então, que a queima do papel é um processo espontâneo, enquanto a reconstituição do mesmo seria um processo não espontâneo.
Nessa situação, tínhamos um sistema mais ordenado (o papel inteiro), que passou para um estado de desordem após a queima (sobras da queima do papel). Podemos concluir, então, que a entropia do sistema, ou seja, seu grau de desordem aumentou.
No estudo da Física, a desordem significa o número de estados que um sistema pode assumir. Para entendermos um pouco mais esse conceito, consideremos o exemplo do gás de cozinha vazando de um botijão. Quando o gás vaza, a entropia do sistema aumenta e ele se espalha por toda a cozinha, sendo pouquíssimo provável que ele se reúna num só canto. Isso acontece porque é o estado ou a configuração mais provável, ou seja, que corresponde ao maior número possível de distribuição de suas moléculas.
Assim, a possibilidade de o gás se concentrar num dos cantos da cozinha representa um menor número de distribuições equivalentes entre as suas moléculas, por isso, tem pouquíssima probabilidade de ocorrer espontaneamente. E mesmo que isso ocorresse, as colisões entre as moléculas fariam com que elas se espalhassem rapidamente por todo o ambiente outra vez. Isso quer dizer que a natureza, espontaneamente, tende para os estados que apresentam maior probabilidade de existirem, ou seja, aqueles de maior entropia.
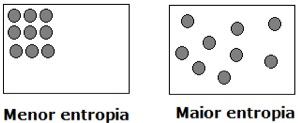
Dessa forma, os processos espontâneos estão, em geral, relacionados com o aumento da entropia, e esse aumento, nada mais é do que a mudança para um estado com um maior número possível de configurações entre as moléculas. Voltando ao exemplo do papel: as sobras do papel queimado é um sistema menos ordenado, pois todas as partículas que o formam podem assumir muito mais configurações do que unidas no papel inteiro. Com base nisso, chegamos à conclusão que o grau de desordem de um sistema é representado pela sua entropia: quanto mais desorganizado for o sistema, maior será a sua entropia.
Esse aumento da entropia é uma expressão da Segunda Lei da Termodinâmica, que afirma que, num sistema isolado (que não realiza trocas de energia com a vizinhança), a entropia nunca diminui, podendo apenas aumentar ou permanecer constante. E já que essa lei está associada à direção do tempo na qual as mudanças ocorrem espontaneamente, podemos dizer que o tempo segue para frente porque a entropia sempre aumenta.
O acontecimento dos mais diversos fenômenos do universo se deve ao aumento da entropia. Sem essa desagregação, as partículas não teriam tantas possibilidades de configuração, logo, nenhum processo químico ou físico poderia ocorrer
Referências bibliográficas
MACHADO, Andrea Horta, MORTIMER, Eduardo Fleury. Química volume único. São Paulo: Scipione, 2005.
Por: Mayara Lopes Cardoso