A cinética química é a parte da química que estuda as velocidades das reações onde, com o aumento da temperatura se aumenta a velocidade.
Existem fatores que influenciam na velocidade como “temperatura”, “superfície” e “concentração de reagentes”.
Velocidade de uma reação
A velocidade de uma reação é a variação da concentração dos reagentes pela variação de uma unidade de tempo. As velocidades das reações químicas geralmente são expressas em molaridade por segundo (M/s).
A velocidade média de formação de um produto de uma reação é dado por:
Vm = variação da concentração do produto / variação do tempo
A velocidade da reação decresce com o tempo. A velocidade de formação do produto é igual a velocidade de consumo do reagente.:
Velocidade da reação = variação da concentração dos reagentes / variação do tempo
A velocidade das reações química pode ocorrer em escalas de tempo muito amplas. Por exemplo, uma explosão pode ocorrer em menos de um segundo, a cocção de um alimento pode levar minutos ou horas, a corrosão pode levar anos, e a erosão de uma rocha pode ocorrer em milhares ou milhões de anos.
Fatores que influenciam na velocidade da reação:
- Superfície de contato: Quanto maior a superfície de contato, maior será a velocidade da reação.
- Temperatura: Quanto maior a temperatura, maior será a velocidade da reação.
- Concentração dos reagentes: Aumentando a concentração dos reagentes, aumentará a velocidade da reação.
Numa reação química, a etapa mais lenta é a que determina sua velocidade. Observe o exemplo a seguir: O peróxido de hidrogênio reagindo com íons iodeto, formando água e oxigênio gasoso.
I – H2O2 + I– ⇒ H2O + IO– (Lenta)
II – H2O2 + IO– ⇒ H2O + O2 + I– (Rápida)
Equação simplificada: 2 H2O2 ⇒ 2 H2O + O2.
A equação simplificada corresponde a soma das equações I e II. Como a etapa I é a etapa lenta, para aumentar a velocidade da reação, deve-se atuar nela. Tanto para aumentar ou diminuir a velocidade da reação, a etapa II (rápida) não vai influir; sendo a etapa I a mais importante.
A lei de Guldberg-Waage:
Considere a seguinte reação: a A + b B ⇒ c C + d D
Segundo a lei de Guldberg-Waage; V = k [A]a [B]b.
Onde:
- V = velocidade da reação;
- [ ] = concentração da substância em mol / L;
- k = constante da velocidade específica para cada temperatura.
A ordem de uma reação é a soma dos expoentes das concentrações da equação da velocidade. Utilizando a equação anterior, calculamos a ordem de tal reação pela soma de (a + b).
Teoria da colisão
Pela teoria da colisão, para haver reação é necessário que:
- as moléculas dos reagentes colidam entre si;
- a colisão ocorra com geometria favorável à formação do complexo ativado;
- a energia das moléculas que colidem entre si seja igual ou superior à energia de ativação.
Colisão efetiva ou eficaz é aquela que resulta em reação, isto é, que está de acordo com as duas últimas condições da teoria da colisão. O número de colisões efetivas ou eficazes é muito pequeno comparado ao número total de colisões que ocorrem entre as moléculas dos reagentes.
Quanto menor for a energia de ativação de uma reação, maior será sua velocidade.
Uma elevação da temperatura aumenta a velocidade de uma reação porque aumenta o número de moléculas dos reagentes com energia superior à de ativação.
Regra de van’t Hoff – Uma elevação de 10°C duplica a velocidade de uma reação.
Esta é uma regra aproximada e muito limitada.
O aumento da concentração dos reagentes aumenta a velocidade da reação.
Energia de ativação:
É a energia mínima necessária para que os reagentes possam se transformar em produtos. Quanto maior a energia de ativação, menor será a velocidade da reação.
Ao atingir a energia de ativação, é formado o complexo ativado. O complexo ativado possui entalpia maior que a dos reagentes e dos produtos, sendo bastante instável; com isso, o complexo é desfeito e dá origem aos produtos da reação. Observe o gráfico:
Onde:
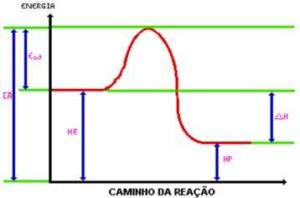
C.A.= Complexo ativado.
Eat. = Energia de ativação.
Hr. = Entalpia dos reagentes.
Hp. = Entalpia dos produtos.
DH = Variação de entalpia.
Catalisador:
O catalisador é uma substância que aumenta a velocidade da reação, sem ser consumida durante tal processo.
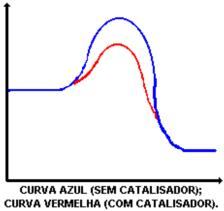
A principal função do catalisador é diminuir a energia de ativação, facilitando a transformação de reagentes em produtos. Observe o gráfico que demonstra uma reação com e sem catalisador:
Inibidor: é uma substância que retarda a velocidade da reação.
Veneno: é uma substância que anula o efeito de um catalisador.
A ação do catalisador é abaixar a energia de ativação, possibilitando um novo caminho para a reação. O abaixamento da energia de ativação é que determina o aumento da velocidade da reação.
- Catálise homogênea – Catalisador e reagentes constituem uma só fase.
- Catálise heterogênea – Catalisador e reagentes constituem duas ou mais fases (sistema polifásico ou mistura heterogênea).
Enzima
Enzima é uma proteína que atua como catalisador em reações biológicas. Caracteriza-se pela sua ação específica e pela sua grande atividade catalítica. Apresenta uma temperatura ótima, geralmente ao redor de 37°C, na qual tem o máximo de atividade catalítica.
Promotor de reação ou ativador de catalisador é uma substância que ativa o catalisador, mais isoladamente não tem ação catalítica na reação.
Veneno de catalisador ou inibidor é uma substância que diminui e até destrói a ação do catalisador, sem tomar parte na reação.
Autocatálise
Autocatálise – Quando um dos produtos da reação atua como catalisador. No início, a reação é lenta e, à medida que o catalisador (produto) vai se formando, sua velocidade vai aumentando.
Conclusão
Na cinética química estuda-se a velocidade das reações químicas.
As velocidades das reações químicas são expressas por M/s “molaridade por segundo”.
Quanto maior for a temperatura, maior será a velocidade, existindo fatores que influenciam nessa velocidade, como “superfície”, “temperatura” e “concentração dos reagentes”, onde, quanto maior for a superfície de contato maior será a velocidade de reação, quanto maior a temperatura maior será a velocidade de reação, quanto maior for a concentração dos reagentes maior será a velocidade de reação.
“lei de Guldberg-Waage” lei onde a ordem de uma reação é a soma dos expoentes das concentrações da equação da velocidade
Existe uma energia mínima para que os reagentes se transformem em produto, essa “energia mínima” da se o nome de “energia de ativação”, quanto maior for a energia de ativação, menor será a velocidade da reação.
Para diminuir essa “energia de ativação” pode-se usar um catalisador que facilita a transformação de reagentes em produtos.
Por: Eduardo Faia Miranda
Veja também:
- Catálise e Catalisadores
- Teoria das Colisões
- Reações Endotérmicas e Exotérmicas
- Reações Espontâneas e Não Espontâneas
- Evidências de Reações Químicas
- Oxidação e Redução
Exercícios resolvidos sobre o conteúdo: