Existem muitas reações químicas cujos reagentes não estão na mesma proporção estequiométrica, por isso, são classificados em dois tipos:
• Reagente limitante – aquele que é totalmente consumido, finalizando a reação e limitando a quantidade de produto originado.
• Reagente em excesso – aquele que não será completamente consumido, sobrando uma dada quantidade ao fim da reação.
Para entendermos melhor a ideia de reagente em excesso e reagente limitante, imaginemos o seguinte caso:
Um conjunto de mesa de jantar é formado por 1 mesa e 4 cadeiras. Quantos conjuntos podemos formar se tivermos 60 mesas e 200 cadeiras.
4 cadeiras ———- 1 conjunto x = 200 / 4
200 cadeiras ——- x x = 50 conjuntos
Observe que, com esta quantidade de cadeiras podemos formar 50 conjuntos de mesa de jantar. Porém, para compor 50 conjuntos precisaremos apenas de 50 mesas, restando, assim, 10 delas. Dessa forma, podemos concluir que as cadeiras são itens limitantes, pois a produção de conjuntos de mesas de jantar cessará quando todas as cadeiras forem usadas. Enquanto as mesas são os itens em excesso, pois parte delas sobrará após serem formados todos os conjuntos.
Com as reações químicas nas quais os reagentes não estão na mesma proporção estequiométrica acontece algo parecido. Assim como as mesas, parte do reagente em excesso sobrará no final da reação e, assim como as cadeiras, os reagentes limitantes condicionarão a quantidade de produto obtido e interromperão o processo. Veja um exemplo de reação química em que isso ocorre:
Numa mistura de 40 g de gás hidrogênio e 40g de gás oxigênio para produzir água, qual substância será o reagente em excesso e qual será o reagente limitante? Dadas as massas atômicas: H = 1; O = 16).
Observe nesta equação que 2 mols de H2 reagem com 1 mol de O2, logo, a proporção é de 2:1. Então, como os reagentes não estão na mesma proporção, esta reação sempre terá um reagente em excesso e um reagente limitante.
Para determinar qual será o tipo de cada um dos reagentes, começaremos calculando a quantidade de O2 que reagiria com os 40 g de H2.
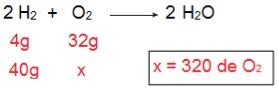
Através do cálculo é possível entender que são necessários 320 g de O2 para reagir completamente com 40 g de H2, no entanto, o enunciado informa que a quantidade de O2 é de apenas 40 g. Logo, podemos concluir que o H2 é o reagente em excesso, porque sobrará uma parte no fim da reação; enquanto o O2 é reagente limitante, pois será o primeiro a ser consumido, encerrando a reação e determinando a quantidade de produto.
Podemos comprovar isto se fizermos o cálculo inverso, ou seja, se determinarmos a quantidade de H2 que reagiria com 40 g de O2.
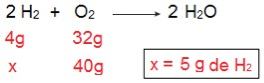
Agora chegamos ao resultado de 5 g de H2, ou seja, são necessários 5 g de H2 para reagir completamente com 40 g de O2, o que é perfeitamente possível, visto que disponibilizamos de 40 g da H2. Novamente concluímos que o H2 é o reagente em excesso, ao passo que o O2 é o reagente limitante da reação.
Vale ressaltar que, numa reação em que os reagentes estão na mesma proporção estequiométrica (1:1, por exemplo), todos serão limitantes, não existindo, assim, reagentes em excesso.
Referências bibliográficas
FELTRE, Ricardo. Química volume 1. São Paulo: Moderna, 2005.
USBERCO, João, SALVADOR, Edgard. Química volume único. São Paulo: Saraiva, 2002.