No estudo dos fatores que interferem na velocidade das reações químicas, os químicos William Lewis e Marx Trautz propuseram a Teoria das colisões, que explica como ocorre o rompimento das moléculas dos reagentes e a formação das moléculas dos produtos de uma reação.
De acordo com a teoria das colisões, para que uma reação química aconteça, é necessário que as moléculas do reagente sejam expostas a uma violenta colisão, o que recebe o nome de choque efetivo ou colisão eficaz. Quanto maior for o número de choques por segundo e maior a violência dos mesmos, maior será a probabilidade de ocorrer uma reação e maior também será a velocidade com que essa reação química ocorrerá.
Existem alguns fatores que aumentam a frequência e a violência dos choques entre as moléculas, aumentando, assim, a velocidade das reações. Entre esses fatores podemos citar o aumento da temperatura em que a reação é realizada; o estado físico dos reagentes no momento da colisão; o aumento da pressão; a presença de outras formas de energia, como a eletricidade e a luz (reações fotoquímicas); o aumento da concentração dos reagentes; e a participação de agentes catalisadores, que são substâncias químicas capazes de acelerar uma reação sem serem consumidas no processo.
No entanto, a frequência dos choques por si só, muitas vezes, não é suficiente para que a reação ocorra. É preciso, ainda, que as moléculas dos reagentes apresentem uma orientação adequada no instante da colisão. Um choque de frente, denominado colisão frontal, é mais eficaz do que um choque “de raspão”, chamado de colisão não frontal. Essa orientação do choque varia conforme o formato e o tamanho das moléculas de cada reagente.
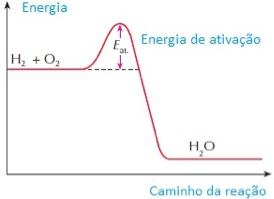
Além da frequência dos choques, da violência com que eles ocorrem e da orientação das partículas no instante da colisão, é necessário, ainda, que as partículas apresentem uma quantidade suficiente de energia capaz de quebrar as ligações químicas dos reagentes, para produzir novas substâncias. Esse valor mínimo de energia necessário para que a reação química aconteça recebe o nome de energia de ativação.
Quando ocorre o choque efetivo entre as partículas, a energia de ativação é atingida e, com isso, forma-se uma estrutura chamada de complexo ativado. Essa estrutura é definida como uma fase intermediária, em que as moléculas dos reagentes já estão unidas, mas os produtos da reação ainda não se formaram. Caso a energia de ativação não seja alcançada, não haverá a formação do complexo ativado, e, consequentemente, não ocorrerá a reação química.
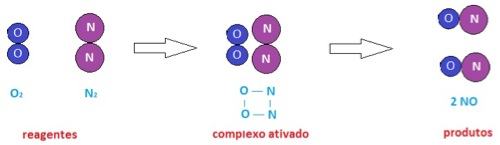
Segunda a teoria das colisões, a energia de ativação atua como uma espécie de barreira, que deve ser ultrapassada para que ocorra a reação. Isso determina a velocidade com a qual a reação química acontece: quanto maior for a energia de ativação, maior será a barreira a ser ultrapassada e, portanto, mais lenta será a reação química. Por outro lado, quando a energia de ativação é menor, a barreira energética também será menor, a chance de ocorrer choques efetivos será maior e a reação ocorrerá mais rapidamente.
Referências bibliográficas:
FELTRE, Ricardo. Química volume 2. São Paulo: Moderna, 2005.
Por: Mayara Lopes Cardoso