Quando ocorre uma ligaçao covalente:
Quando a diferença de eletronegatividade entre dois átomos que formam a ligação não for grande, os átomos ligar-se-ão pelo compartilhamento de alguns de seus elétrons de valência. A ligação é feita por meio de dois elétrons que são atraídos pelos dois núcleos.
Se cada átomo contribui com 1 elétron para estabelecer o par eletrônico, a ligação é chamada covalente comum ou simplesmente covalente. Se os dois elétrons pertencem a um só átomo, a ligação é chamada covalente dativa ou coordenada.
O compartilhamento de elétrons ocorre entre átomos que apresentam 4 ou mais de 4 elétrons na camada de valência. O hidrogênio tem um elétron na camada de valência e também apresenta esse tipo de ligação. Os compostos que apresentam os átomos ligados apenas por ligação covalente são chamados compostos moleculares.
Exemplos de ligações covalentes e dativas:

I) Ligação simples – um par de elétrons compartilhado pelos dois átomos. A molécula de água tem duas ligações simples.

II) Ligação dupla – dois pares de elétrons compartilhados.
III) Ligação tripla – três pares de elétrons compartilhados.
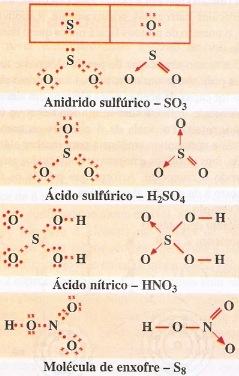
Tanto o enxofre como o oxigênio apresentam 6 elétrons de valência. Um átomo de enxofre liga-se a um átomo de oxigênio por dois pares eletrônicos simples. O outro átomo de oxigênio liga-se ao enxofre por dativa, sendo o par de elétrons fornecido pelo enxofre, que já está com 8 elétrons na camada de valência. O par eletrônico é representado por uma flecha dirigida no sentido doador -» receptor.
Por: Paulo Magno da Costa Torres