O gás perfeito é o gás criado de maneira teórica para facilitar o estudo dos fluídos visto que os gases também são fluídos.
O gás perfeito ou também chamado de gás ideal pode ser definido como o gás teórico onde suas partículas são consideradas pontuais, ou seja, não se movimentam, além disso, elas não trocam energia e nem momento (não interagem entre si). É importante perceber que o gás ideal, é apenas um modelo criado para facilitar o estudo da mecânica dos fluidos.
Como toda teoria física, o gás ideal também respeita algumas leis observadas e equacionadas de maneira compacta, mas antes é importante conhecer as grandezas físicas necessárias para o estudo dos gases. Tais grandezas são:
1 – Volume;
2 – Pressão;
3 – Temperatura.
As leis dos gases ideais são:
1 – Lei de Boyle:
A lei de Boyle basicamente descreve o comportamento de um gás ideal apenas quando sua temperatura é mantida constante (muitas vezes quando a temperatura se mantém constante a transformação é chamada de isotérmica).
Para entender o processo dessa lei imagine um gás contido em um recipiente fechado.
.jpg)
Agora imagine que você pressione a tampa desse recipiente.
.jpg)
Você então perceberá que quanto mais você aumenta a pressão no gás, o seu volume também diminuirá. Logo perceberá que as grandezas volume e pressão são diretamente proporcionais.
Então a lei de Boyle diz matematicamente que:
pV = k
Onde k é uma constante que depende da massa, temperatura e da natureza desse gás.
O gráfico da transformação isotérmica obtida é então:
.jpg)
2 – Lei de Gay Lussac:
A lei de Gay Lussac basicamente descreve o comportamento de um gás ideal apenas quando sua pressão é mantida constante (muitas vezes quando a pressão se mantém constante a transformação é chamada de isobárica).
Para entender o processo dessa lei imagine novamente um gás contido em um recipiente fechado.
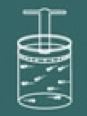
Agora imagine que você esquente o recipiente.

Você então perceberá que quanto mais você o esquenta, a tampa do recipiente irá subir logo a pressão no gás irá diminuir então seu volume irá aumentar. Logo se percebe que as grandezas volume e temperatura são diretamente proporcionais.

Então a lei de Gay Lussac diz matematicamente que:
v = k . T
O gráfico da transformação isobárica obtida é então:
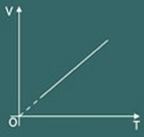
3 – Lei de Charles:
A lei de Charles basicamente descreve o comportamento de um gás ideal apenas quando seu volume é mantido constante (muitas vezes quando o volume se mantém constante a transformação é chamada de isocórica ou isovolumétrica).
Para entender o processo dessa lei imagine novamente um gás contido em um recipiente fechado.
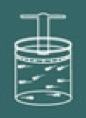
Observe que agora você deve manter a tampa do recipiente travada, pois o volume do gás deve sempre permanecer constante.

Agora imagine que você esquente o recipiente. Você então perceberá que o gás tenderá a aumentar seu volume e como resultado perceberá que a pressão do gás nas paredes do recipiente irá aumentar consequentemente você percebe que a temperatura do sistema irá também aumentar. Como conclusão as grandezas temperatura e pressão são diretamente proporcionais.
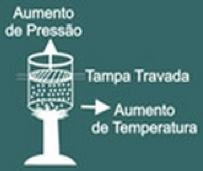
Então a lei de Charles diz matematicamente que:
p = k . T
O gráfico da transformação isovolumétrica obtida é então:
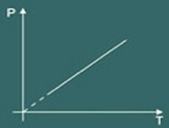
Conhecida essas três leis o cientista chamado Clapeyron conseguiu sintetizar todas elas em apenas uma equação. A denominada equação de Clapeyron que diz:
pV = nRT
Onde: n = numero de moléculas presente no gás
R = constante universal dos gases perfeitos
V = volume do gás
P = pressão do gás
Observação:
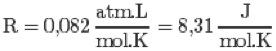
Com as três leis e a equação de Clapeyron, pode-se chegar na equação geral dos gases perfeitos:
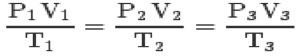
Essa equação quer dizer que os relações dos estados 1,2,3 serão sempre iguais.
Por: Luiz Gulherme Rezende Rodrigues
FONTE:
http://pt.wikipedia.org/wiki/G%C3%A1s_ideal
http://pt.wikipedia.org/wiki/Transforma%C3%A7%C3%A3o_isoc%C3%B3rica