Como os átomos são por dentro? Diante da impossibilidade de dar uma resposta precisa a essa pergunta, procurou-se criar modelos que incorporassem os novos conhecimentos a respeito dos átomos e retratassem a sua constituição.
Modelo Atômico de Dalton:
Dalton foi o primeiro cientista a desenvolver uma teoria atômica, segundo a qual a matéria se compõem de pequeníssimas partículas indestrutíveis chamadas átomos. De acordo com essa teoria, os átomos de determinada substância ou elemento são idênticos entre si, mas são diferentes dos átomos dos outros elementos.
Verificou ainda que as reações químicas não passam de uma redisposição dos átomos, e que, para se obter um composto de substâncias diversas, é preciso formar átomos compostos contendo um número definido de átomos de cada elemento. Essa teoria já está ultrapassada hoje em dia.

Modelo Atômico de Rutherford:
Propôs que o átomo seria como um sistema solar em miniatura, cujo “sol” – o núcleo – concentra quase toda a massa e toda a carga positiva do sistema; gravitando em torno do núcleo, em órbitas elípticas, estão os elétrons, cuja soma de cargas negativas é igual a carga positiva nuclear com o que se tem o equilíbrio elétrico e a consequente estabilidade do conjunto. O dinamarquês Bohr deu uma fundamentação teórica ao modelo.
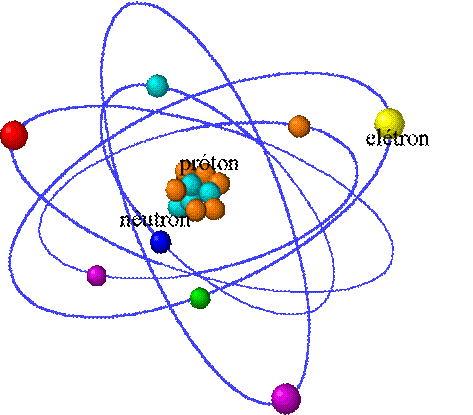
Modelo Atômico de Bohr:
Sugeriu que um átomo de hidrogênio consistia em um único elétron perfazendo uma órbita circular ao redor de um próton central (o núcleo), sendo a energia do próton quantizada (isto é, o elétron poderia carregar apenas uma quantidade bem definida de energia). Com esse modelo, conseguiu explicar a origem das bolsas espectrais.
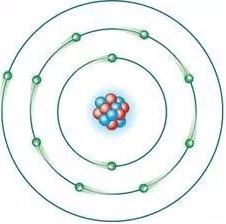
Modelo Atômico Atual
Em 1926, Schrödinger lançou as bases da Mecânica Ondulatória, ao apresentar um modelo atômico no qual os elétrons eram considerados como partículas-onda.
O modelo de Schrödinger, válido até hoje, procura determinar os valores permitidos de energia para os elétrons de um átomo e mostra que é impossível conhecermos a trajetória de um elétron.
Isso já havia sido previsto por Heisenberg, no seu famoso Princípio da Incerteza:
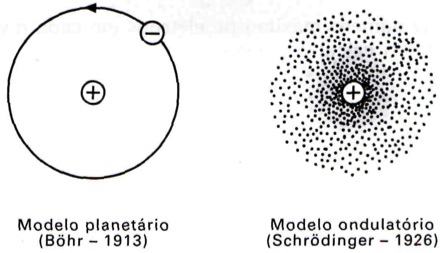
O Modelo Atual e o Modelo de Bohr
No modelo de Bõhr (1913), o elétron descrevia órbitas bem definidas; enquanto no modelo atômico atual (1926), a ideia de órbitas está definitivamente abandonada. Hoje se considera o elétron uma partícula-onda com trajetória desconhecida. Nesse sentido, pode-se falar em nuvem eletrônica, ou seja, o elétron seria uma partícula com posição desconhecida, mas ocupando uma região denominada orbital.
Lembre, finalmente, que qualquer modelo, por mais sofisticado que seja, não passa de uma representação da realidade.
Por razões didáticas, quando um sistema químico puder ser explicado por vários modelos atômicos, escolheremos sempre o mais simples.
Por: Renan Bardine
Veja também:
- Número Atômico e Número de Massa
- Modelo Atômico de Bohr
- Modelo Atômico de Thomson
- Modelo Atômico de Rutherford
- Distribuição Eletrônica