O físico dinamarquês Niels Bohr (1885 – 1962) propôs um modelo atômico para o átomo de hidrogênio que depois foi estendido para outros elementos.
O seu modelo baseia-se no Sistema Solar, no qual os planetas giram ao redor do Sol. Para Bohr, os elétrons giram em órbita ao redor do núcleo atômico agrupados em níveis energéticos.
Baseando-se em experimentos com o efeito fotoelétrico, na teoria quântica dos físicos alemães Planck e Einstein (1879-1955) e nos espectros atômicos, o físico dinamarquês Niels Bohr propôs um modelo atômico formado por um núcleo e uma parte periférica que o envolvesse. Como no modelo de Rutherford, no modelo atômico de Bohr o átomo também é constituído de um núcleo positivo e os elétrons giram em torno dele. A diferença é que no modelo atômico de Bohr os elétrons giram ao redor do núcleo em órbitas circulares, não emitindo nem absorvendo energia. A essas órbitas, Bohr chamou camadas ou níveis de energia.
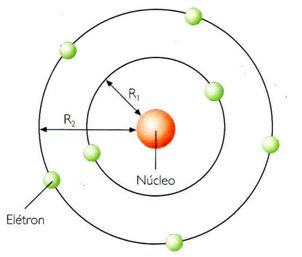
Na teoria de Bohr, os elétrons dão voltas ao redor do núcleo, mas não podem se situar em qualquer ponto do espaço que envolva o núcleo. As órbitas, admitidas circulares em princípio, têm alguns raios (R) permitidos e outros proibidos.
Hoje sabemos que os elétrons giram ao redor do núcleo, mas não em órbita. Para ser considerada uma órbita, o movimento do elétron deveria ser sempre num mesmo plano, o que na prática não acontece. O movimento dos elétrons ao redor do núcleo é parecido ao de uma nuvem que envolve esse núcleo atômico.
No estado fundamental de um átomo, os elétrons se encontram no nível energético mais baixo possível.
Se os elétrons de um átomo recebem energia ou colidem com outros elétrons, eles saltam para níveis mais externos. Neste caso, dizemos que os elétrons entram em estado excitado.
Se os elétrons cedem energia, eles saltam para níveis mais internos e a energia liberada pelos elétrons sai em forma de quantum de luz ou fóton.
A dificuldade para se determinar a trajetória de um elétron ao redor do núcleo atômico consiste em que, para descobri-la, é necessário enviar um fóton ao átomo; mas quando isso acontece, o elétron salta de nível energético, mudando assim a sua trajetória.
O comportamento dos elétrons é parecido com o da luz. Ora eles se comportam como onda, ora como partícula. Durante o seu movimento normal ao redor do núcleo, o comportamento dos elétrons é de onda e quando recebem um fóton, eles se comportam como partícula.
Fonte: Apostila do Curso Positivo
Autoria: Fernando Moraes de Abreu