Os ácidos são compostos moleculares, e podem apresentar-se em temperatura ambiente e pressão normal (condições normais de temperatura e pressão, ou CNTP) nos estados sólido, líquido ou gasoso. Os ácidos fazem parte do nosso cotidiano: estão no vinagre, que contém ácido acético; em refrigerantes, encontramos o ácido carbônico; nos sucos de limão ou laranja, o ácido cítrico.
Características e propriedades
Uma característica dos ácidos que pode ser notada pelo ser humano é o fato deles possuírem sabor azedo. Claro que não podemos ingerir qualquer tipo de ácido – mas sabemos que eles possuem um sabor azedo por conta daqueles que podemos ingerir e fazem parte do nosso dia a dia, especialmente aqueles presentes nas frutas cítricas, no abacaxi e em outros alimentos.
Os ácidos são substâncias agrupadas por dois motivos: primeiramente, possuem uma estrutura química comum e, em segundo lugar, todos possuem características em comum em relação ao seu comportamento.
Por exemplo, os ácidos em solução aquosa sofrem ionização, portanto essas soluções são capazes de conduzir corrente elétrica. Do mesmo modo, os ácidos têm facilidade em reagir com diversos metais e com vários carbonatos e outros compostos orgânicos.
Zn(s) + 2 HCl(aq) → ZnCl2(aq) + H2(g)
2 HCl(aq) + Na2CO3(s) → 2 NaCl(aq) + H2O(l) + CO2(g)
Definição
Os ácidos foram primeiramente definidos pelo químico sueco Arrhenius, em experiências na Universidade de Uppsala. Arrhenius observou que algumas substâncias, quando diluídas em água, eram capazes de conduzir corrente.
Os ácidos sofrem ionização e, nesse processo, conforme definiu o sueco, produzem um único cátion em comum – o íon H+. Claro que os ácidos, por constatação, eram conhecidos desde a Antiguidade – como substâncias corrosivas. De qualquer modo, o conceito de Arrhenius elucidava o comportamento dos ácidos nas reações químicas, formulando um ponto em comum.
Exemplo:
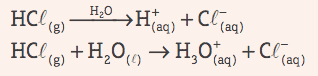
O conceito de ácido e seu comportamento nas soluções aquosas foi aprimorado e revisitado, contudo, ao longo dos tempos. Entretanto, nem sempre vemos os ácidos ou os analisamos apenas em soluções aquosas – e então Johannes Nicolaus Brønsted, físico-químico dinamarquês, descobriu que ácidos reagiam com bases. Juntamente com o colega Lowry, em 1923, Bronsted formulou que os ácidos eram substâncias que “doavam prótons”. Isso ampliava o conceito de Arrhenius, uma vez que cobria também reações que não envolviam soluções aquosas.
Porém a química avançou e um conceito que englobaria todos os ácidos foi formulado finalmente pelo norte-americano Gilbert Newton Lewis. “Doar prótons” é algo que a química sabe ser improvável, e além disso, os conceitos anteriores deixavam de fora alguns dos ácidos existentes. Embora todo ácido Brønsted-Lowry seja um ácido de Lewis, normalmente o uso do termo ácido de Lewis é frequentemente reservado para aqueles ácido de Lewis que não são ácidos de Brønsted-Lowry.
O “ácido de Lewis” é toda aquela substância na qual um dos elementos constituintes possui uma deficiência de elétrons. Para sanar essa deficiência, ele reage com qualquer substância capaz de doar um ou mais elétrons até que o elemento deficiente se torne estável.
Classificação dos ácidos
Os ácidos compreendem uma classe de substâncias vasta e com incontáveis elementos e formas. Assim sendo, convencionou-se classificá-los de diversas maneiras distintas:
1. Quanto à presença ou não de oxigênio
Os hidrácidos são ácidos que não apresentam oxigênio em sua estrutura (HCN, HCl, H2S), e os oxiácidos (H2SO4, H2SO3 e HNO3) são ácidos que têm oxigênio em sua estrutura. Aqui há uma particularidade – como veremos a seguir, ácidos são classificados também por sua “força”. Entre os hidrácidos, encontramos apenas três ácidos fortes:
- HCl (ácido clorídrico)
- HBr (ácido bromídrico)
- HI (ácido iodídrico)
2. Quanto ao número de hidrogênios ionizáveis
Nos hidrácidos, todos os átomos de hidrogênio das moléculas podem ser ionizados; já nos oxiácidos, apenas os hidrogênios ligados aos oxigênios são ionizáveis. Considerando isso, podemos classificar os ácidos com base no número de átomos de hidrogênio que cada um deles libera, durante a reação. Os ácidos podem ser monoácidos, diácidos, triácidos e assim por diante, conforme esse número.
- Monoácido: HCN(g) → H+(aq) + CN–(aq)
- Diácido: H2SO4 → 2H+(aq ) + SO2-4(aq)
- Triácido: H3PO4 → 3H+(aq) + PO3-4(aq)
3. Quanto à força
Força em um ácido significa, necessariamente, o “poder de ionização” desse ácido. Um ácido forte é aquele capaz de gerar uma grande ionização em solução.
A força dos hidrácidos é dada pelo grau de ionização α, que corresponde à porcentagem de moléculas ionizadas no meio em questão. Ou seja, a força será determinada pela “porcentagem” da substância a atingir ionização quando dissolvida.
α = número de moléculas ionizadas / número de moléculas dissolvidas
Exemplo: HCl: a cada 100 moléculas dissolvidas em água, 92 sofrem ionização.
α = 92/100 = 0,92 ou 92% de moléculas ionizadas
| CLASSIFICAÇÃO | GRAU DE IONIZAÇÃO | EXEMPLOS |
|---|---|---|
| Forte | α > 50% | HCl |
| Moderado | 5% < α < 50% | HF |
| Fraco | α < 5% | H2CO3 |
A força dos oxiácidos é dada pela diferença entre o número de átomos de oxigênio e o de átomos de hidrogênio ionizáveis. Ou seja, efetuamos uma conta com base na formulação inicial do próprio ácido.
HnAm (m – n = força do ácido).
Exemplo:
H2SO4: 4 O – 2 H = 2 → ácido forte
| NÚMERO DE OXIGÊNIOS- -NÚMERO DE HIDROGÊNIOS | FORÇA DO ÁCIDO | EXEMPLOS |
|---|---|---|
| 0 | Fraco | HCLO |
| 1 | Moderado | HNO3 |
| 2 ou 3 | Forte | HBrO4 |
4. Quanto à volatilidade
Indica a facilidade com que as substâncias passam do estado líquido para o gasoso, ou seja, o quão facilmente a substância se torna volátil. Grande parte dos ácidos são compostos voláteis e alguns deles inclusive são gasosos em temperatura ambiente. Nesse contexto, podemos dividir os ácidos em duas classes:
- Voláteis (baixas temperaturas de ebulição): (a grande maioria dos ácidos): HCN, HNO3 , HCl, H2S. Os ácidos orgânicos mais voláteis são o metanoico (CH3OOH), o etanoico (CH3 —COOH) e o propanoico (CH3—CH2—COOH).
- Fixos (altas temperaturas de ebulição): H2SO4, H3PO4 e H3BO3
Nomenclatura dos ácidos
A nomenclatura dos ácidos possui uma regra razoavelmente simples, porém há distinções de nomenclatura entre os hidrácidos e os oxiácidos. E, no caso de alguns ácidos, ainda é possível encontrar nomes “usuais”, como no caso do ácido muriático (ácido clorídrico), vitamina C (ácido ascórbico) e outros.
1. Hidrácidos
Os hidrácidos são denominados da seguinte maneira:
Ácido + Nome do elemento -ídrico
Exemplos:
- HCl: ácido clorídrico
- HBr: ácido bromídrico
- HCN: ácido cianídrico
2. Oxiácidos
Uma maneira simples de dar a nomenclatura dos oxiácidos considera a fórmula e o nome de alguns ácidos ditos como ácidos-padrão pertencentes a cada família da Tabela Periódica. Os ácidos-padrão são:
- H2SO4: ácido sulfúrico
- HNO3: ácido nítrico
- H3PO4: ácido fosfórico
- HClO3: ácido clórico
- H2CO3: ácido carbônico
A partir desses cinco ácidos-padrão, com a variação apenas no número de oxigênios, teremos diversos ácidos diferentes, e suas respectivas nomenclaturas serão dadas a partir da alteração nos prefixos e sufixos dos ácidos-padrão, de acordo com a seguinte tabela:
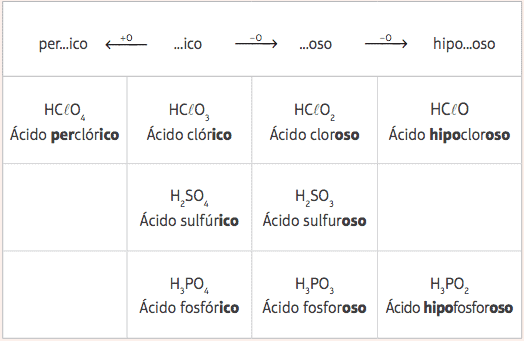
Exemplos:
HClO = HClO3 – 2 oxigênios
Nomenclatura: Adicionam-se o prefixo hipo- e o sufixo –oso → Ácido hipocloroso
HClO4 = HClO3 + 1 oxigênio
Nomenclatura: Adicionam-se o prefixo per- e o sufixo –ico → Ácido perclórico.
H3PO3 = H3PO4 – 1 oxigênio
Nomenclatura: Adiciona-se o sufixo –oso → Ácido fosforoso
Por: Carlos Artur Matos