Nesta aula-virtual, veremos de que forma podemos classificar substâncias como ácidos ou bases, as principais propriedades destes grupos, o conceito de pH e a força relativa destas substâncias.
As duas funções mais importantes da química: ácidos e bases. São os grandes pilares de toda a vida de nosso planeta, bem como da maioria das propriedades do reino mineral. Íons carbonatos e bicarbonatos (ambos básicos) estão presentes na maior parte das fontes de água e de rochas, junto com outras substâncias básicas como fostatos, boratos, arsenatos e amônia.
Em adição, vulcões podem gerar águas extremamente ácidas pela presença de HCl e SO2. A fotossíntese das plantas pode alterar a acidez da água nas vizinhanças por produzir CO2, a substância geradora de ácido mais comum na natureza. A fermentação do suco de frutas pode vir a produzir ácido acético. Quando utilizamos nossos músculos em excesso sentimos dores provocados pela liberação de ácido lático.
Com tamanha frequência em nosso ambiente, não é de se espantar que os ácidos e bases tenham sido estudados por tantos séculos. Os próprios termos são medievais: “Ácido” vem da palavra latina “acidus”, que significa azedo. Inicialmente, o termo era aplicado ao vinagre, mas outras substâncias com propriedades semelhantes passaram a ter esta denominação. “Álcali”, outro termo para bases, vem da palavra arábica “alkali”, que significa cinzas. Quando cinzas são dissolvidas em água, esta se torna básica, devido a presença de carbonato de potássio. A palavra “sal” já foi utilizada exclusivamente para referência ao sal marinho ou cloreto de sódio, mas hoje tem um significado muito mais amplo.
Os íons hidrônio e hidróxido
A água é uma substância deveras bizarra. Entre várias propriedades anômalas, há uma de particular interesse no estudo de ácidos e bases: a autoionização. De fato, duas moléculas de água podem interagir e produzir dois íons: um cátion, o hidrônio, e um ânion, o hidróxido. É uma reação onde ocorre uma transferência de próton de uma molécula de água para outra. A existência da autoionização da água foi provada, ainda no século IXX, por Friedrich Kohlraush. Ele descobriu que a água, mesmo que totalmente purificada e de-ionizada, ainda apresenta uma pequena condutividade elétrica. Kohlraush atribuiu esta propriedade à existência de íons na água, mais precisamente íons hidrônios e hidróxidos.
A compreensão da autoionização da água é o ponto de partida para os conceitos de ácidos e bases aquosos.
Conceitos de ácidos e bases
Um dos primeiros conceitos de ácidos e bases que levavam em conta o caráter estrutural das moléculas foi desenvolvido no final do século 19, por Svante Arrhenius, um químico sueco. Ele propôs que os ácidos eram substâncias cujos produtos de dissociação iônica em água incluiam o íon hidrogênio (H+) e bases as que produzem o íon hidróxido (OH-).
Este conceito, embora utilizado até hoje, tem sérias limitações:
1) só pode ser empregado a soluções aquosas;
2) o íon H+, de fato, sequer existe em solução aquosa;
3) não pode ser aplicado para outros solventes.
4) segundo este conceito, somente são bases substâncias que possuem OH- em sua composição.
É verdade para o NaOH, mas outras substâncias, como a amônia, não são bases de acordo com o conceito de Arrhenius.
Em 1923, J.N. Bronsted, em Copenhagen (Denmark) e J.M. Lowry, em Cambridge (England) independentemente sugeriram um novo conceito para ácidos e bases. Segundo eles, ácidos são substâncias capazes de doar um próton em uma reação química. E bases, compostos capazes de aceitar um próton numa reação. Este conceito ficou conhecido como “definição de Bronsted”, pois este e seus alunos foram mais ágeis na difusão da nova ideia. Esta nova definição é bem mais ampla, pois explica o caráter básico da amônia e o caráter ácido do íon amônio, por exemplo.

Repare que, na reação com amônia, a água se comporta como um ácido, pois doa um próton; já na reação com o amônio, a água se comporta como uma base, pois aceita um próton deste íon.
A água, portanto, é um exemplo de substância anfiprótica, isto é, moléculas que podem se comportar como um ácido ou como uma base de Bronsted.
De acordo com Bronsted, a dissociação do HCl promove a formação de outro íon: o íon hidrônio

Como vimos, a noção de ácidos e bases de Bronsted envolve, sempre, a transferência de um próton – do ácido para a base. Isto é, para um ácido desempenhar seu caráter ácido, ele deve estar em contato com uma base. Por exemplo: o íon bicarbonato pode transferir um próton para a água, gerando o íon carbonato.
Como a reação é reversível, o íon carboxilato pode atuar como uma base, aceitando, na reação inversa, um próton do íon hidrônio – que atua como um ácido. Portanto, os íons bicarbonato e carbonato estão relacionados entre si, pela doação ou ganho de um próton, assim como a água e o íon hidrônio. Um par de substâncias que diferem pela presença de um próton é chamado de par ácido-base conjugado.
Desta forma, o íon carbonato é a base conjugada do ácido bicarbonato, e o íon hidrônio é o ácido conjugado da base H2O.
O íon HPO42- é a base conjugada do íon H2PO4-.
Identificação de ácidos e bases
Em água, alguns ácidos são melhores doadores de prótons do que outros, enquanto que algumas bases são melhores aceptoras de prótons do que outras. Por exemplo: uma solução aquosa de HCl diluída consiste, praticamente, de íons cloreto e hidrônio, uma vez que quase 100% das moléculas do ácido são ionizadas. Por isso, este composto é considerado um ácido de Bronsted forte.
Em contraste, uma solução diluída de ácido acético contém apenas uma pequena quantidade de íons acetato e hidrônio – a maior parte das moléculas permanece na forma não ionizada. Este composto é, portanto, considerado um ácido Bronsted fraco.
De acordo com o modelo de Bronsted, um ácido doa um próton para produzir uma base conjugada. Entretanto, esta base conjugada pode vir a aceitar o próton de volta, retornando ao ácido conjugado. A espécie capaz de se ligar mais fortemente ao próton é que vai determinar a força do ácido ou da base. Portanto,
a) quanto mais forte for o ácido, mais fraca é a base conjugada
Neste caso, a ligação H-A é bastante fraca, e o íon A- é estável, ou seja, é uma base fraca.
b) quanto mais fraco for o ácido, mais forte é a base conjugada.
Isto significa que a ligação H-A é uma ligação forte, pois o íon A- é pouco estável e representa uma base forte, que tende a recapturar o próton.
Numa solução aquosa de HCl, duas bases entrarão numa disputa pelo próton: o íon cloreto e a água. Como a água é uma base mais forte, praticamente todo o HCl perde o próton para esta.

Já numa solução aquosa de ácido acético, a água sai perdendo: a base mais forte é o íon acetato! Por isso, apenas parte das moléculas deste ácido sofrem ionização.
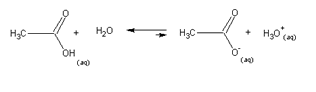
Como vimos anteriormente, a água sofre um processo de autoionização, produzindo íons hidrônios e hidróxidos.
Entretanto, como o íon hidróxido é uma base muito mais forte do que a água, da mesma forma que o íon hidrônio é um ácido muito mais forte, o equlíbrio é grandemente deslocado para o lado esquerdo da equação. De fato, a 25oC, apenas 2 de cada um bilhão de moléculas sofrem autoionização. Quantitativamente, podemos descrever o processo como:
Todavia, em água pura ou em uma solução aquosa diluída, o termo [H2O] é uma constante (55,5 mol/L). Desta forma, podemos simplificar a equação acima como:
Keq.[H2O]2 = Kw e Kw = constante de ionização da água = [H3O+].[OH-] a 25oC, Kw = 1,008 x 10-14 M2
Esta expressão de Kw é muito importante, e deve ser memorizada, pois é através dela que todos os conceitos de pH e pOH são deduzidos.
O equilíbrio da reação entre o ácido acético e a água pode ser descrito pela constante abaixo:
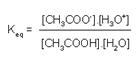
Novamente, no caso de soluções diluídas, o termo [H2O] é constante, e podemos substituir a equação por Keq. [H2O]=Ka, que fica:

Esta é a expressão para a constante de ionização ácida, Ka. Da mesma forma, podemos escrever a expressão para Kb, a constante de ionização básica. Vamos utilizar a reação da amônia com água como exemplo:
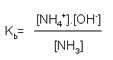
Veja também:
- Nomenclatura de ácidos, bases, sais e óxidos
- Exercícios sobre Conceitos de Ácidos e Bases
- Ácidos Carboxílicos