A água é a substância mais abundante tanto dentro do corpo humano quanto em nosso planeta. É, também, a substância mais procurada por astrônomos em outros corpos celestes, já que ela torna possível a vida como a conhecemos aqui na Terra.
Todos os seres vivos são formados por água e vivem em habitats determinados pela quantidade de água existente, o que faz dessa substância o elemento fundamental para a vida na Terra e possivelmente encontrado em outros planetas.
Apesar de 70 a 75% da superfície da Terra estar imersa em água, ela não está acessível ao consumo do ser humano quando se encontra na forma de gelo ou vapor, por exemplo.
A molécula de água é formada por dois átomos de hidrogênio ligados a um átomo de oxigênio, por meio de ligações covalentes. Como os elétrons são deslocados para perto do átomo de oxigênio, formando uma zona negativa e outra positiva do lado oposto, podemos classificá-la como uma molécula polar.
As propriedades da água
Coesão
Uma característica importante é que as moléculas de água fazem ligações de hidrogênio, ou seja, os átomos de hidrogênio (com carga positiva) interagem com outro átomo mais eletronegativo, como é o caso do oxigênio (com carga negativa).
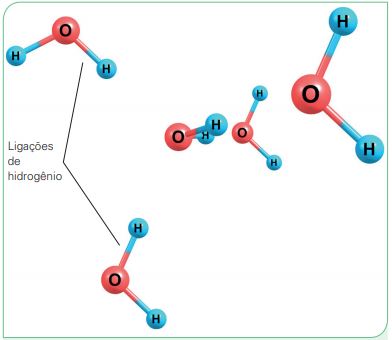
Essa ligação, conhecida como propriedade de coesão, possibilita que as moléculas fiquem fortemente unidas, garantindo que a água seja estável e fluida em condições normais de temperatura e pressão.
Adesão
A adesão é responsável pela aderência das moléculas de água a outras substâncias polares. Essa capacidade permite, por exemplo, a água molhar, pois se mistura com outras substâncias.
Transporte de substâncias
A capilaridade é um fenômeno físico resultante das interações entre as forças de adesão e coesão da molécula de água. É a capacidade que essa substância tem de ser “contínua” e conseguir atravessar poros, subir por tubos ou descer por superfícies.
É graças à capilaridade que a água passa por espaços estreitos, contra a gravidade. Um exemplo disso é a forma como as plantas obtêm água e nutrientes diluídos provenientes do subsolo.

Tensão superficial
Essa força de atração entre as moléculas possibilita a existência de um fenômeno chamado de tensão superficial, que aparenta ser uma película fina na superfície da água, formada pelas ligações de hidrogênio (coesão) entre as moléculas.
Por causa dessa característica, insetos conseguem pousar sob a água sem afundar. A água tem uma tensão superficial maior que dos outros líquidos.

Calor específico
Outro aspecto importante das moléculas de água é o alto calor específico. Ou seja, é necessária muita energia para que ela altere sua temperatura, o que faz com que essas moléculas consigam absorver ou ceder uma grande quantidade de calor sem alterar seu estado físico.
Como consequência, a água é considerada termorreguladora, por conseguir estabilizar a temperatura corporal dos seres vivos compatíveis às condições ambientais.

Solvente universal
A água em qualquer um dos seus estados (sólido, líquido ou gasoso) é considerada um solvente universal, por favorecer as reações químicas nas células e por dissolver a maioria dos solutos, dissociando-os ou hidratando-os.
Isso ocorre porque as moléculas de água têm capacidade de hidrossolubilidade. Ou seja, conseguem facilmente separar ou dissociar partículas em virtude de seu caráter polar, o que reduz as forças de atração dos íons encontrados em outras substâncias, possibilitando a eles se dissociar.
As substâncias que são dissolvidas na água são hidrofílicas (hidro = água; philus = amigo), enquanto as que não se dissolvem são hidrofóbicas (hidro = água; phobos = medo). Por exemplo, a água não adere às moléculas apolares, como as de gordura, de óleo e de cera, que são lipídios. É por isso que a água forma gotas em superfícies enceradas ou oleosas.
Dilatação anômala
Ao se congelar, a água se dilata, ou seja, aumenta de volume: uma massa de gelo tem um volume maior que a mesma massa de água líquida. A esse fenômeno é dado o nome de dilatação anômala da água.
A densidade da água varia com a temperatura, de maneira que a densidade máxima (1 g/cm3) corresponde à água líquida a uma temperatura de 3,98 °C O gelo é menos denso. Também é menos densa a água mais quente.
A dilatação anômala da água é multo importante nos ecossistemas aquáticos. Em um lago de montanha, por exemplo, a água se congela com a chegada do inverno, mas, já que o gelo flutua o congelamento ocorre apenas com uma delgada camada de água situada na superfície.
A água em baixo está muito fria, porém o gelo a isola das baixas temperaturas do exterior e, assim, não chega a se congelar. Em virtude disso, as plantas e os animais aquáticos podem sobreviver no inverno. Na hidrosfera, normalmente, sempre há água líquida debaixo do gelo.
Outras funções importantes da água são
- é a molécula fundamental no processo de hidrólise (hidro = água; lise = quebra), no qual há quebra de uma molécula na presença de água, para resultar em outros dois compostos distintos com os elementos advindos dessa quebra;
- é necessária para que as enzimas consigam atuar como catalisadoras das reações químicas;
- atua na distribuição das substâncias nas células por meio de seu fluxo (ciclose);
- lubrifica as articulações e os olhos, além de compor a saliva.
Por: Wilson Teixeira Moutinho