Enzimas são proteínas especiais de função catalisadora, isto é, são substâncias biológicas que aumentam a velocidade das reações químicas celulares sem alterar o produto das reações.
A grande maioria das reações metabólicas celulares que ocorrem em um organismo, capazes de manter a vida, só são possíveis na presença de enzimas, sem as quais essas reações ocorreriam muito lentamente o que não seria condizente com os processos biológicos presentes nos seres vivos.
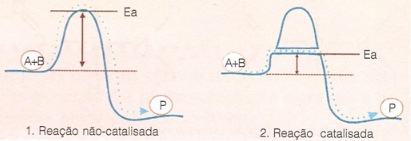
As enzimas aumentam a velocidade das reações bioquímicas, na ordem de 1014x, diminuindo a energia de ativação celular. A energia de ativação é a quantidade mínima de energia necessária para que uma reação química aconteça.
Por exemplo, se em um laboratório você quer que uma reação química aconteça, precisa misturar os reagentes A e B e esperar que eles atinjam a energia de ativação formando o produto C.
No entanto, para que a reação se processe de forma mais rápida e atinja a energia de ativação velozmente, pode-se usar artifícios, como agitar o tubo onde os compostos estão colocados, ou ainda, levar ao fogo para aquecimento, aumentando a agitação molecular e favorecendo o encontro das moléculas. Isso facilita a ocorrência de uma determinada reação sem a participação de um catalisador.
Já nos organismos vivos, esses artifícios usados em laboratório, como agitação do tubo e aquecimento com temperaturas elevadas, não são possíveis. Sendo assim, a única maneira que a natureza encontrou para fazer com que a vida fosse possível foi com a participação das enzimas, que fazem com que as reações celulares ocorram de modo bastante rápido.
As enzimas têm uma outra característica muito interessante: não são consumidas durante as reações. Dessa maneira, a mesma enzima pode catalisar o mesmo tipo de reação várias vezes.
Enzimas são proteínas que atuam como biocatalisadores, diminuindo a energia de ativação e aumentando a velocidade da reação, sem alterar o produto final e sem serem consumidas durante as reações.
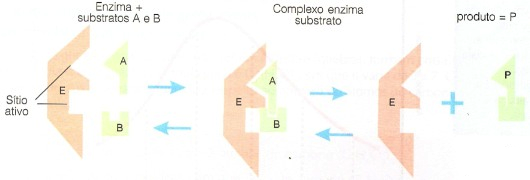
A + B (Reagentes) + E (Enzima) = Produto (P) + E (Enzima)
Esquema demonstrando o curso de uma reação não-catalisada e de uma reação catalisada por enzima:
Especificidade enzimática
As enzimas são proteínas específicas, ou seja, cada uma cataliza apenas um tipo de reação química, ou, um pequeno número de reações. Isto se deve à sua forma, a qual apresenta na superfície encaixes moleculares, os sítios ou centros ativos, onde os substratos ou reagentes se ligam.
Por isso, substratos diferentes daqueles que se encaixam nos sítios ativos de uma enzima específica não podem fazer parte daquela reação, deve existir uma outra enzima para catalisar a sua reação.
A especificidade das enzimas para os seus substratos é semelhante à especificidade entre uma fechadura e a sua chave.
Principais fatores que interferem na ação enzimática
Influência da temperatura
A temperatura é um dos principais fatores que influenciam a ação enzimática, sendo que cada organismo apresenta uma temperatura ótima para a ação de suas enzimas. Até esse limite ótimo, a cada 10°C de elevação da temperatura, a velocidade de reação tende a duplicar ou triplicar.
Porém, se a temperatura passar do limite ótimo, a velocidade da reação tende a diminuir e se chegar a valores muito elevados que variam para cada organismo, em média 45°C a 50°C, as enzimas sofrerão um desenrolamento de sua estrutura, perdendo suas propriedades biológicas. Esse processo é chamado de desnaturação enzimática.
Se as enzimas deixam de funcionar, as reações por elas catalisadas cessam completamente. O contrário também acontece: a cada 10°C que se abaixa a temperatura, a atividade enzimática se reduz à metade ou à terça parte, porém nessa situação as enzimas não são desnaturadas, podendo voltar a funcionar naturalmente caso retornem a sua temperatura ideal.
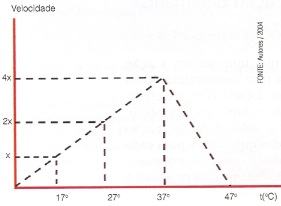
Por exemplo, a temperatura ótima para o funcionamento da maioria das enzimas humanas está em torno de 37° C. Se em um laboratório você tivesse uma enzima humana em um tubo de ensaio a 17°C, agindo sobre os seus substratos, a uma velocidade X, e aumentasse a temperatura para 27° C, a velocidade da reação duplicaria e passaria então para 2 X. Se a temperatura fosse elevada para 37°C, teríamos um aumento ainda maior da velocidade atingindo 4 X.
Porém, se continuássemos a aumentar a temperatura progressivamente além dos 37°C, a velocidade não mais aumentaria, pelo contrário, ocorreria a desnaturação da enzima levando a velocidade da reação a zero.
Veja o gráfico abaixo.
Por: Renan Bardine